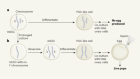
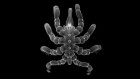
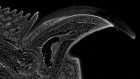
被称为类器官的肾样结构可以从干细胞中生长出来。来源:夏实验室
西中村龙一(Ryuichi Nishinakamura)对构建可移植肾脏的探索始于20世纪90年代,当时这位肾病学家发现自己几乎没有什么可以提供给病人的。有时他会因为设定这样一个不切实际的目标而被嘲笑,“但我当时非常天真和年轻,所以我就勇往直前,”西中村回忆道,他现在是日本熊本大学的干细胞生物学家。
但是1998年人类胚胎干细胞的发现和2006年诱导多能干细胞的发现使得培育新鲜肾脏的任务似乎更容易实现。许多研究人员从iPS细胞中分化出各种类型的肾细胞,并生长出肾“类器官”——具有多种类型肾细胞的微小器官样结构,部分模拟肾脏结构和功能。2013年,西村的实验室实现了早期的里程碑之一,展示了小鼠和人类的类肾器官1.许多实验室现在正在生产功能更强大的类器官,这些器官被证明在模拟肾脏发育和疾病方面很有用。
自然展望的一部分:慢性肾脏疾病
但西中村实现可移植人类肾脏的目标还需要很多年。澳大利亚墨尔本默多克儿童研究所的发育生物学家梅丽莎·利特尔说:“我们确实在盘子里放了肾脏。”“但如果我们移植它会有用吗?”这是一个更大的问题。”
新加坡南洋理工大学的干细胞生物学家夏云(音)说:“我们正处于一个瓶颈。”他认为,当今的研究与人们的需求之间存在巨大差距。像她的许多同事一样,夏担心,为了保持其在资助者和公众中的可信度,类器官研究需要在治疗方面取得进展。一些研究小组正在研究“辅助肾脏”,它的大小只是正常肾脏的一小部分,但仍然可以稳定一个人的健康。
复杂性的挑战
在实验室里复制肾脏是一个非常棘手的器官。利特尔说:“你有25-30种不同的细胞类型,它们具有不同的功能,必须在解剖学上被放置在正确的位置,才能使器官工作。”相比之下,心脏被认为只有九种主要的细胞类型2.
肾脏清除血液中废物的功能单位,肾元,是一个复杂而精确的组织结构。过滤血液的第一步发生在被称为肾小球的小血管网络中。然后产生的滤液通过一系列的管道,在这些管道中,各种溶质与血管交换,最后进入一个分支的收集管道树,将废物输送到输尿管,然后流向膀胱。要使肾脏发挥功能,仅仅拥有正确的细胞是不够的,它们还必须正确排列。
在通往可移植肾脏的道路上仍有许多令人生畏的障碍。最大的问题之一是这些细胞的不成熟,它们通常类似于人类发育的第一或第二三个月的祖细胞,限制了它们的功能。
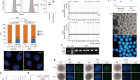
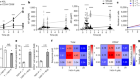
在这方面取得了稳步进展。例如,在2022年,利特尔和她的同事们展示了功能更强大的人类近端小管细胞,她称之为肾脏的“发电厂”3..同年,马萨诸塞州波士顿布里格姆妇女医院的肾病学家约瑟夫·邦文特(Joseph Bonventre)实验室对收集管的两种主要功能细胞类型进行了同样的研究4.
研究人员还研究出了如何提高他们在体积上制造肾脏类器官的能力,这是潜在治疗的另一个关键要求。例如,荷兰的研究人员已经大规模培育了ips细胞衍生的肾元5.
像来自多能干细胞的其他形式的组织一样,肾脏类器官可能包括不受欢迎的脱靶细胞,如肌肉神经元,研究人员需要遵循精确的协议来防止肿瘤细胞的出现。干细胞领域的普遍进步使这些挑战最小化。
然而,形成一个脉管系统是一个更大的障碍。一个完全发展和精确结构的血液系统是需要保持流动的血液和尿液交换在整个肾单位正确。英国爱丁堡大学的发育生物学家和组织工程师杰米·戴维斯(Jamie Davies)说,这在实验系统中还没有实现。相反,血管系统通常保持在原始状态,很快就会消亡。
Nishinakamura说,移植到免疫缺陷小鼠体内的类器官确实会吸引宿主动物的血管,使肾元开始过滤血液并产生尿液。然而,尿液无处可去,所以移植通常在这个阶段失败,他说。
为建模增加维度
基于iPS细胞构建更好的类器官的推动极大地增加了研究人员对肾脏发育和疾病的理解。与细胞培养相比,类器官已经提供了肾脏疾病的增强模型,特别是儿童的遗传疾病。利特尔说,例如,包裹在肾小球毛细血管周围并开始过滤过程的关键细胞,即足细胞,在2D细胞培养中是“垃圾”,但在3D类器官中表现得更好。
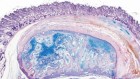
类器官模型也很容易显示常染色体显性多囊肾病的特征性囊肿,多囊肾病是最常见的遗传性肾病,也是密集研究的对象之一。2022年的一项研究报告了一个可扩展的人类肾脏类器官平台,能够测试针对这种情况的数百种小分子药物6.
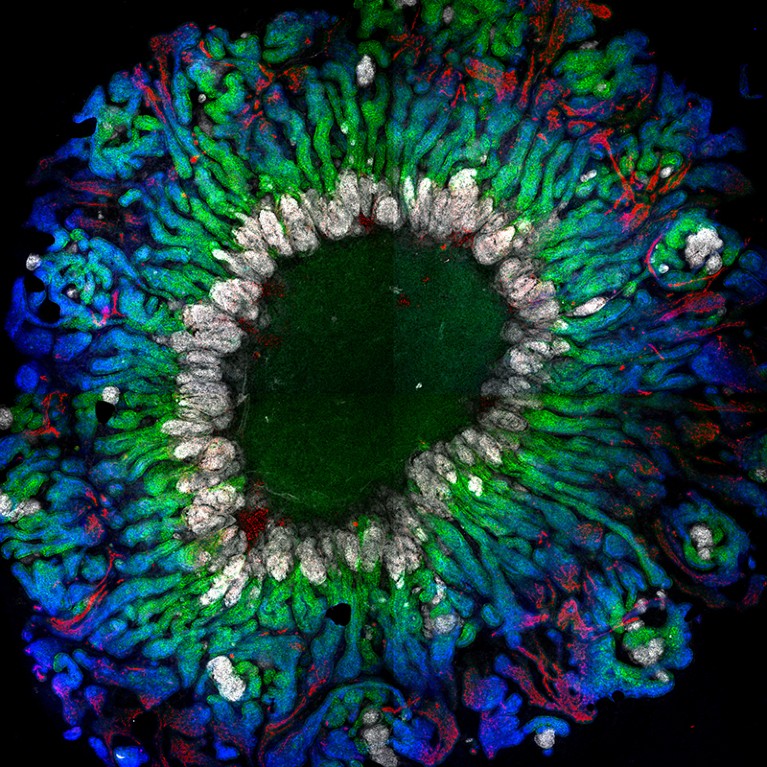
研究人员现在能够用功能更强的细胞培育出肾脏类器官。资料来源:J. M. Vanslambroucket al。自然Commun.13, 5943(2022)。
糖尿病是成人慢性疾病的最大驱动因素,但建模是一项艰巨的任务,因为这种疾病会损害血管,而血管在类器官中难以繁殖。此外,夏说,肾类器官,像许多细胞培养物一样,通常沐浴在高水平的葡萄糖中,因此很难找出糖尿病引起的血糖水平升高的影响。
肾脏类器官在药物测试中大有前途。Bonventre说,许多候选药物在测试中失败,因为它们会导致肾脏损伤,但在2D细胞培养中不会发现这一点,因为它们经常失去敏感性。例如,他说,蛋白质KIM-1是近端小管细胞损伤的一个强有力的生物标志物在活的有机体内-但不是在2D细胞培养。如果肾脏类器官能显示与所见相同的KIM-1基因表达模式在活的有机体内他说,在美国,它们将提供极好的毒性模型。他的实验室正在研究这种基于有机的模型。
治疗的具体步骤
使用基于iPS细胞的类器官来治疗肾脏疾病远远不是第一个提出的基于细胞的治疗方法。许多临床试验已经测试了间充质干细胞(在组织中发现的多能干细胞,如骨髓)的效果,结果好坏参半。大多数研究人员都认为,尽管这些细胞可能会分泌有助于肾脏修复的因子,但它们并不能从结构上改善肾脏。一项长期研究的替代技术,从肾病患者身上选择、增强和重新植入肾细胞,正在由北卡罗来纳州温斯顿-塞勒姆的生物技术公司ProKidney赞助的III期临床试验中进行检查。
但是,Nishinakamura说,将ips细胞为基础的类器官细胞单独注射到肾脏中似乎并不是一个有前途的策略。他说,这些细胞可能分泌改善肾功能的因子,就像间充质干细胞被认为的那样。但这些祖细胞不太可能留在肾脏内愉快地玩耍;目前尚不清楚这些细胞会去哪里,也不清楚它们是否会成熟以及如何成熟。
西班牙巴塞罗那加泰罗尼亚生物工程研究所的干细胞生物学家蒙特塞拉特(Núria Montserrat)说,类器官来源的细胞可能有助于改善捐赠肾脏的移植。她正在与荷兰格罗宁根大学(University of Groningen)的移植外科医生西里尔·莫尔斯(Cyril Moers)合作验证这一假设。捐献的器官通常在移植前被灌注在液体浴中而不是冷冻。摩尔斯希望,在这些浴液中加入类器官来源的细胞,可以使这些器官得到更好的保存,更准确地评估,并(最终)在移植前变得更健康。蒙特塞拉特的实验室正在进行试点实验,将人类类器官细胞释放到灌注的猪肾中。
更广泛地说,一些研究小组正在研究将更丰富的类器官组织移植到肾病患者体内的可能性。利特尔想要创造一种她称之为辅助肾脏的东西,用来连接一个人衰竭的肾脏。
在她的实验室未发表的实验中,移植到免疫缺陷小鼠体内的人类肾脏类器官成功地收集了血管,并开始过滤尿液。“让所有这些肾元连接到底层肾脏将是一个挑战,”她说。“如果肾元连接到现有的肾脏本身,那么尿液就会像所有尿液一样排出。你基本上是在利用现有病人肾脏的解剖结构,即使病人的肾脏已经病得很严重。”

更多信息来自《自然展望》
位于加州圣地亚哥的生物技术公司Trestle Biotherapeutics也在开发一种可移植的辅助肾脏。联合创始人、发育生物学家爱丽丝·陈(Alice Chen)说,这些组织可能最终会出现在另一个位置,比如在膀胱附近的现有肾脏下方。她说,Trestle正在培育的类器官是科学文献中常见报道的类器官的100倍左右,并且在这些组织如何移植到小鼠体内、与宿主循环连接并继续成熟方面取得了令人鼓舞的进展。
这家初创公司成立的初衷是,生物工程肾脏将需要许多快速发展学科的工业规模的专业知识,包括干细胞科学和3D生物打印。陈说:“我们必须把所有的脑力、技术和想法结合起来。”
大多数患有肾病的人都希望治疗能让他们过上正常的生活——取代或减少透析,或推迟对捐赠肾脏的迫切需求——而不是一个完整的生物工程器官。Chen说:“我们并不是在创造一个完整的器官,我们需要创造一些能够为这些患者恢复10-20%功能的组织。”“这是可以实现的。”
一些研究小组正在使用类器官作为潜在的细胞来源,用于生物工程3D支架的混合外部设备,旨在发挥改进的透析系统的作用。
在这样的努力中,Bonventre希望制造一个只有两种类型的细胞亚群的设备:近端小管细胞和收集导管细胞。他说,其他类型的肾细胞仍然很重要,但实现正常肾脏的所有功能似乎是一个遥远的目标。他说:“我们不要瞄准30亿光年之外的星系。”“让我们先去月球,也许再去火星。”
但西中村仍然坚持他最初的梦想,他认为,对于数百万慢性肾病稳步发展到终末期肾病的人来说,这比以往任何时候都更需要一个完整的肾脏。“我总是告诉我的研究生,‘不要说这是不可能的’。”

 研究人员研究慢性肾脏疾病
研究人员研究慢性肾脏疾病 SGLT2抑制剂为肾脏疾病治疗注入了活力
SGLT2抑制剂为肾脏疾病治疗注入了活力 停止拒绝非公民的肾脏移植
停止拒绝非公民的肾脏移植 追求透析股权
追求透析股权 面对糖尿病肾病的种族和民族差异
面对糖尿病肾病的种族和民族差异 植入式人工肾脏能否终结透析的需要?
植入式人工肾脏能否终结透析的需要? 基因革命改变了肾脏疾病
基因革命改变了肾脏疾病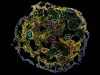 慢性肾脏疾病:研究要点
慢性肾脏疾病:研究要点