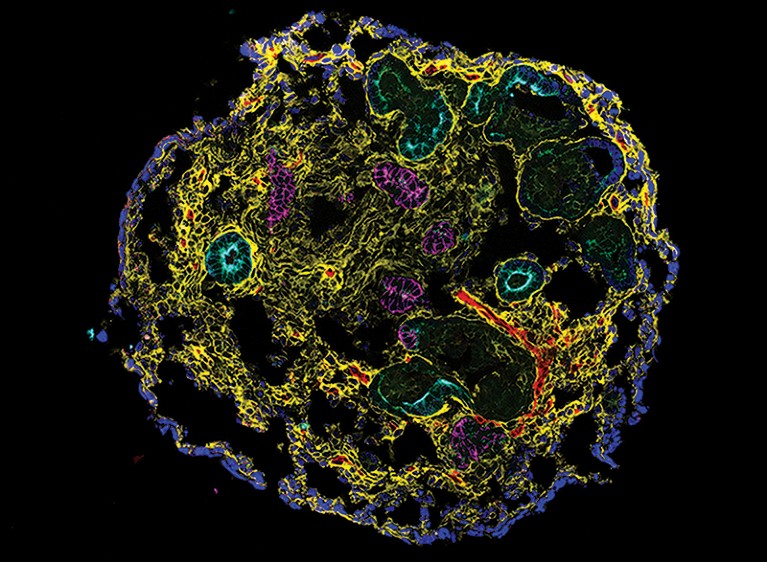
含肾单位上皮细胞和间质细胞的肾类器官。来源:N. Guptaet al。科学。Transl。地中海。14, eabj4772(2022)。
每个人的基因组风险评分
目前的估计表明,一个人患慢性肾病(CKD)的风险有四分之一到一半可以归因于他们的基因。然而,这些估计所依据的遗传数据主要是欧洲血统的个体,这使开发广泛适用于人群的预测测试的努力复杂化。这尤其成问题,因为已知不同种族和民族群体的风险因素存在差异。最值得注意的是,非洲血统的人更有可能携带基因变异APOL1增加CKD可能性的基因由纽约哥伦比亚大学的科学家领导的一个团队现在设计了一种多基因风险评分,可以识别出患慢性肾病风险最高的人。它基于多种与疾病相关的基因组序列变异的综合影响,而与一个人的种族或民族无关。
自然展望的一部分:慢性肾脏疾病
作者首先根据2019年对100万参与者遗传数据的元分析,确定了与肾功能受损有很强统计关联的基因变异。由于本研究偏向于欧洲和东亚血统的个体,本研究的作者还包括来自7158名非洲血统的英国生物银行捐赠者的队列风险数据。特别地,他们着重于特定的风险贡献与贡献的变异APOL1基因。
研究人员随后对来自不同背景的15组人群进行了风险评分的测试。其中包括六组非洲血统的参与者,四组东亚和南亚血统的参与者,以及两组拉丁裔的参与者。作者的评分在所有评估人群中表现一致,根据该评分排名在风险前2%的个体被诊断为CKD的可能性是其三倍。这一评分的未来迭代可以指导预防保健,以避免高风险人群发生CKD,并有可能指导肾脏捐赠器官的筛选和选择。
肾脏疾病研究人性化
开发CKD有效干预措施的一个挑战是,动物模型不能完全反映人类生物学,可能无法预测人类的疗效和安全性。波士顿麻省总医院的研究人员及其同事的一项研究表明,复制肾脏关键结构和功能特征的基于干细胞的人类类器官模型如何能够深入了解CKD的潜在机制,这可能与临床相关。
从诱导多能干细胞开始——经过实验诱导进入胚胎样状态的成年细胞——作者应用了一种培养系统,促进成熟和自组织到肾类器官中。它们具有肾脏组织的独特管状结构,周围环绕着支持细胞,包括成纤维细胞和周细胞。该模型允许作者研究CKD的早期阶段,当复发性损伤导致肾小管损伤不能完全修复的状态时,为进一步的组织损伤和纤维化铺平了道路。
在类器官中重现这些条件后,作者分析了受损管状细胞基因表达的变化。他们的数据强调了几个DNA修复基因,它们在成功的组织修复过程中被激活,但当小管修复不完全时,它们的表达急剧下降。作者随后证实了在活检样本中称为FANCD2的修复酶表达的这种转变。
在这些证据的基础上,他们用一种刺激FANCD2活性的药物治疗他们的类器官模型,证明这种治疗可以延缓受损小管的萎缩和纤维化。这些实验强调了人类类器官模型作为CKD研究工具的前景。
科学。Transl。地中海.14, eabj4772 (2022).
肾纤维化中的免疫因子
纤维化瘢痕组织的形成和积累是CKD进展的核心,而一个公认的炎症成分是这一过程的基础。然而,涉及哪些免疫细胞亚群以及这些细胞如何与肾脏组织相互作用尚不清楚。
费城宾夕法尼亚大学的一组研究人员和他们的同事通过深入的比较转录组分析实验解决了这个问题。来自健康小鼠肾脏组织的数万个细胞的信使RNA与来自CKD动物模型肾脏的细胞mRNA进行了比较,以确定哪些基因被激活或被抑制。通过使用基因表达对这些不同的细胞类型进行分类,作者发现纤维化肾组织倾向于高度富集嗜碱性粒细胞。这是一种罕见的炎症细胞亚型,以前与肾脏的免疫疾病有关,但不是专门与CKD有关。
随后的分析显示,在纤维化肾脏中,近端小管(肾过滤机制的关键部分)中的细胞表达一种名为CXCL1的蛋白质,可以积极招募嗜碱性粒细胞。它们随后释放出一系列引发炎症的信号分子。人体组织样本进一步证实了这一机制,在纤维化肾脏中可以明显检测到CXCL1表达的富集和嗜碱性粒细胞的聚集。研究人员在小鼠身上测试了他们的发现,发现要么选择性地消除嗜碱性粒细胞,要么阻断其炎症信号的作用,都可以减少甚至预防纤维化。确定一种特定的免疫细胞亚群作为疾病进展的基础,将有助于开发保护肾脏健康和功能的治疗方法。
一个拦截炎症的机会
sphingosin 1-phosphate (S1P)是一种促炎生物分子,有助于CKD进展过程中肾脏纤维化组织的形成。药物可以通过抑制S1P受体来阻断S1P的活性,但这些药物已被证明在肾病患者中表现不佳,并可能引发严重的副作用。
弗吉尼亚大学夏洛茨维尔分校的研究人员和他们的同事们现在已经剖析了S1P是如何导致肾纤维化的,并确定了一种机制,通过这种机制,他们可以有效地破坏这一过程。他们特别关注了肾血管周围细胞的作用,这些细胞排列在肾脏的毛细血管上,与免疫系统密切联系。早期的研究也强烈表明,这些细胞中S1P的产生直接参与纤维化的发生。
首先,作者证实,在这些肾细胞中抑制S1P的产生可以抑制通常由肾损伤引起的促炎反应。然后,他们确定这种反应依赖于一种叫做Spns2的蛋白质。血管周围细胞利用Spns2将新合成的S1P释放到细胞外空间,在细胞外空间中,它可以与其受体结合,从而引发炎症。
这表明有机会打破导致纤维化的免疫事件链。作者测试了一种新发现的Spns2小分子抑制剂,并表明它可以减轻培养的人血管周围细胞的炎症反应。他们还观察到这种药物在啮齿动物肾纤维化模型中的保护作用,而现有的一种阻断S1P受体的药物没有这种益处。这些治疗效果是否适用于CKD患者还有待观察,但初步结果表明,靶向Spns2可能为预防或减缓纤维化提供一种有前途的途径。
科学。Transl。地中海.14, eabj2681 (2022).
保护心脏健康
许多CKD患者还会经历高血压,这种情况会进一步加剧肾脏疾病,同时也会恶化心血管健康。印第安纳波利斯印第安纳大学的研究人员进行的一项临床试验现在证明,一种已经用于治疗高血压的药物也可以为晚期CKD患者提供安全而有意义的保护。
氯噻酮是一种利尿剂,已知可以降低中风和心力衰竭的风险,但对于给晚期CKD患者服用氯噻酮或相关化合物一直存在一些担忧。为了测试患有这一阶段疾病的人是否可能受益,作者随机选取了160名患有严重CKD和高血压的患者,让他们接受氯噻酮或安慰剂12周的治疗,同时接受其他标准化的抗高血压药物治疗。

更多信息来自《自然展望》
与安慰剂组相比,治疗组在开始治疗的四周内血压显著下降。两组之间的血压差异在整个研究过程中一直存在,在治疗停止12周时仍然具有统计学意义。超过这一点,治疗臂的血压又开始上升。服用氯噻酮的患者还表现出其他临床改善的迹象,包括体重减轻和心脏衰竭风险的各种血液生物标志物水平降低。重要的是,与安慰剂组相比,治疗组的不良事件总体上仅略有增加,需要住院治疗的严重事件较少。
虽然这是一项小型研究,女性和亚洲或西班牙裔人群的代表性不足,但它提供了证据,证明这种药物可以保护CKD患者的心脏和肾功能。作者说,需要在更大的队列中进行III期试验来证明该药物的疗效。

 研究人员研究慢性肾脏疾病
研究人员研究慢性肾脏疾病 SGLT2抑制剂为肾脏疾病治疗注入了活力
SGLT2抑制剂为肾脏疾病治疗注入了活力 停止拒绝非公民的肾脏移植
停止拒绝非公民的肾脏移植 追求透析股权
追求透析股权 面对糖尿病肾病的种族和民族差异
面对糖尿病肾病的种族和民族差异 类器官如何促进对慢性肾脏疾病的认识
类器官如何促进对慢性肾脏疾病的认识 植入式人工肾脏能否终结透析的需要?
植入式人工肾脏能否终结透析的需要? 基因革命改变了肾脏疾病
基因革命改变了肾脏疾病