摘要gydF4y2Ba
昼夜节律在许多生物过程中起着至关重要的作用,只需要三种原核蛋白就可以构成一个真正的翻译后昼夜节律振荡器gydF4y2Ba1gydF4y2Ba.三种Kai蛋白的进化史表明,KaiC是最古老的成员,也是时钟的核心组成部分gydF4y2Ba2gydF4y2Ba.随后加入KaiB和KaiA调节KaiC的磷酸化状态以实现时间同步。蓝藻中典型的KaiABC系统已经被很好地理解gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba但对于那些只拥有KaiBC的更古老的系统,我们知之甚少。然而,有报道称,它们可能表现出一种基本的沙漏式计时机制gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.在这里我们研究原始的生物钟gydF4y2BaRhodobacter sphaeroidesgydF4y2Ba,其中只包含KaiBC,以阐明其内部工作,尽管没有KaiA。利用x射线晶体学和低温电子显微镜的结合,我们发现了KaiC的一个新的十二聚体折叠,其中两个六聚体由一个由12个螺旋组成的线圈束连接在一起。这种相互作用是由KaiC的羧基末端延伸形成的,并作为一个古老的调控部分,后来被KaiA取代。白天和夜间构象之间的盘式线圈寄存器移位通过跨越140 Å的远程变构网络连接到磷酸化位点。我们的动力学数据确定了昼夜之间atp与adp比率的差异,作为驱动时钟的环境线索。他们还揭示了揭示自维持振荡器演化的机械细节。gydF4y2Ba
主要gydF4y2Ba
昼夜节律钟是自我维持的生物振荡器,在原核生物和真核生物中普遍存在。在真核生物中,这些系统是复杂和高度复杂的,而在原核生物中,核心机制是由翻译后振荡器调节的,该振荡器可以在体外用ATP和三种蛋白质(由ATP编码)重建gydF4y2BakaiAgydF4y2Ba,gydF4y2BakaiBgydF4y2Ba而且gydF4y2BakaiCgydF4y2Ba)gydF4y2Ba1gydF4y2Ba.KaiABC系统的开创性工作已经导致了对其生物钟的全面了解。KaiC是通过与KaiA结合而自磷酸化的中心成分,并在与KaiB结合后自去磷酸化gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.这三种蛋白质之间的相互作用已在体外被证明构成了一个真正的昼夜节律振荡器,其特点是持久性、复位和温度补偿。因此,KaiABC系统被认为是一种优雅且最简单的昼夜节律实现。动物的进化史gydF4y2Ba凯gydF4y2Ba建立基因gydF4y2BakaiCgydF4y2Ba作为最古老的成员,可以追溯到35亿年前。后续增加的gydF4y2BakaiBgydF4y2Ba最近gydF4y2BakaiAgydF4y2Ba形成现存gydF4y2BakaiBCgydF4y2Ba而且gydF4y2BakaiABCgydF4y2Ba集群,分别gydF4y2Ba2gydF4y2Ba,gydF4y2Ba10克ydF4y2Ba.值得注意的是,一些对更原始生物的研究缺乏gydF4y2BakaiAgydF4y2Ba暗示了gydF4y2BakaiBCgydF4y2Ba基于系统的系统可能已经提供了一个基本的沙漏式计时机制gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.与蓝藻中发现的自我维持振荡器相反,这样的计时器需要环境线索来驱动时钟和每天的沙漏翻转。昼夜节律在许多生物过程中的核心作用,由地球上的昼夜周期控制,使它们的进化成为一个迷人的话题。gydF4y2Ba
在这里,我们通过对紫色非硫光合变形菌KaiBC系统的生化和结构研究来研究这样一个原始的生物钟gydF4y2BaR。gydF4y2BasphaeroidesgydF4y2BaKD131(以下,其组分称为KaiBgydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaRSgydF4y2Ba).生物体在体内表现出持续的基因表达节律,但是否gydF4y2BakaiBCgydF4y2Ba是对这一观察结果仍不确定的原因吗gydF4y2BakaiCgydF4y2Ba基因敲除gydF4y2Ba11gydF4y2Ba.之前对这种密切相关的细菌的研究gydF4y2BaRhodopseudomonas palustrisgydF4y2Ba使用敲除菌株证明了固氮的原始昼夜节律和蛋白表达之间的因果关系gydF4y2BakaiCgydF4y2Ba基因gydF4y2Ba9gydF4y2Ba.这里通过体外实验,我们发现KaiBCgydF4y2BaRSgydF4y2Ba原始的昼夜节律钟与广泛研究的昼夜节律振荡器的机制不同吗gydF4y2Ba聚球藻属elongatusgydF4y2BaPCC 7942(以下,其组件称为KaiAgydF4y2BaSEgydF4y2Ba, KaiBgydF4y2BaSEgydF4y2Ba和KaiCgydF4y2BaSEgydF4y2Ba)gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.我们发现了一种环境线索,可以调节磷酸化状态,从而在体内产生24小时时钟,作为昼夜之间atp - adp比率的开关。我们的动力学研究结果结合x射线和低温电子显微镜(cryo-EM)相关状态的结构,揭示了一个对沙漏功能至关重要的远程变构途径,并阐明了自维持振荡器的演化。值得注意的是,我们发现了KaiC的一个新的蛋白质折叠gydF4y2BaRSgydF4y2Ba并在该系统中发现了一个跨度约115 Å的线圈域的寄存器移位作为关键调节器,这显示出与动力蛋白信号在结构上的相似性gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
c端尾巴是一个原始的调节部分gydF4y2Ba
来深入了解gydF4y2BakaiBCgydF4y2Ba聚类,我们构建了一个系统发育树gydF4y2BakaiCgydF4y2Ba在gydF4y2BakaiBgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba扩展数据图gydF4y2Ba1gydF4y2Ba及补充数据集gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).我们想要回答的第一个问题是KaiC如何gydF4y2BaRSgydF4y2Ba分支中的其他成员可以自磷酸化,尽管没有KaiA。已知KaiA在典型KaiABC体系的最佳温度下对这一功能至关重要。我们观察到一个大的分支,它的c端尾巴长了大约50个氨基酸gydF4y2BakaiCgydF4y2Ba在其他演化支(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).A环附近的c端延伸主要出现在gydF4y2BakaiC2gydF4y2Ba亚组,先前被注释为具有两个丝氨酸磷酸化位点,而不是在gydF4y2BakaiC1gydF4y2Ba而且gydF4y2BakaiC3gydF4y2Ba子组gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).在gydF4y2Ba年代。gydF4y2BaelongatusgydF4y2Ba, KaiA的绑定gydF4y2BaSEgydF4y2Ba到KaiC的A循环gydF4y2BaSEgydF4y2Ba将它们系在一个暴露的构象中gydF4y2Ba16gydF4y2Ba这激活了自磷酸化和核苷酸交换gydF4y2Ba17gydF4y2Ba.考虑到延伸的c端尾部与A环的接近性,我们推测它可能作为KaiA出现后多余的“原始”调节部分。gydF4y2Ba
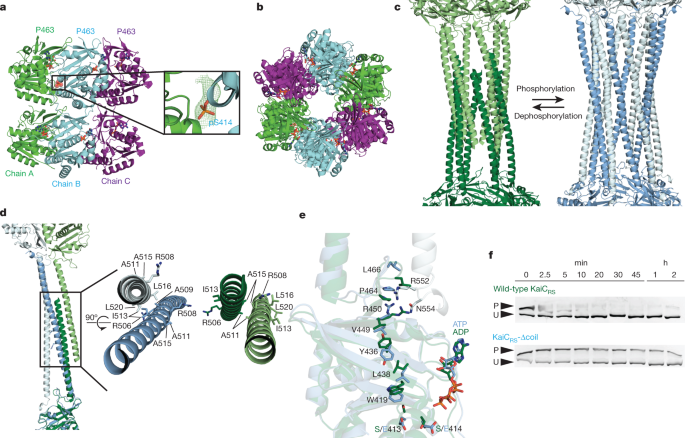
一个gydF4y2Ba的系统发育树示意图gydF4y2BakaiCgydF4y2Ba表现出…的样子gydF4y2BakaiBgydF4y2Ba而且gydF4y2BakaiAgydF4y2Ba在进化过程中。的gydF4y2BakaiCgydF4y2Bac端延伸约50个氨基酸的分支标记为红色,并预测了之前报道的时间线gydF4y2Ba2gydF4y2Ba.十亿年前。gydF4y2BabgydF4y2Ba, KaiC磷酸化率随时间的变化gydF4y2BaRSgydF4y2Ba(6.5±1.0 hgydF4y2Ba−1gydF4y2Ba)及KaiCgydF4y2BaSEgydF4y2Ba在存在(0.40±0.02 hgydF4y2Ba−1gydF4y2Ba)或KaiA的缺失gydF4y2BaSEgydF4y2Ba30°C。拟合得到报告参数中的s.d.。gydF4y2BacgydF4y2Ba, KaiC中ATP与mant-ATP之间的核苷酸交换gydF4y2BaRSgydF4y2Ba单独(18.0±1.5 hgydF4y2Ba1gydF4y2Ba)与KaiC相比gydF4y2BaSEgydF4y2Ba在存在(4.7±0.3 hgydF4y2Ba1gydF4y2Ba)和KaiA的缺失gydF4y2BaSEgydF4y2Ba(0.08±0.04 hgydF4y2Ba1gydF4y2Ba)测量温度为30°C。有代表性的痕迹显示,拟合参数(平均值±s.d)从三个重复测量获得。gydF4y2BadgydF4y2Ba,十二羧基KaiC的x射线结构gydF4y2BaRSgydF4y2Ba(PDB:gydF4y2Ba8 dbagydF4y2Ba)以六聚体A(浅绿色)和六聚体B(深绿色)着色。表示了CI, CII和卷曲线圈域,并在A环中标记gydF4y2BaegydF4y2Ba.gydF4y2BaegydF4y2Ba,基于KaiC的CII域对齐的叠加gydF4y2BaRSgydF4y2Ba(绿色;PDB:gydF4y2Ba8 dbagydF4y2BaB), KaiCgydF4y2BaSEgydF4y2Ba(紫色;PDB:gydF4y2Ba1 tf7gydF4y2Ba2 .答案B。gydF4y2Ba36gydF4y2Ba和KaiCgydF4y2BaSEgydF4y2Ba-S431E / T432A(黄色;PDB:gydF4y2Ba7 s65车型gydF4y2BaA)gydF4y2Ba19gydF4y2Ba表明KaiCgydF4y2BaRSgydF4y2Ba具有扩展的A环方向,不再与422环(KaiCgydF4y2BaSEgydF4y2Ba编号)。KaiC中422环的构象gydF4y2BaRSgydF4y2Ba类似于在拟磷KaiC的低温电镜结构中看到的结构gydF4y2BaSEgydF4y2Ba-S431E / T432A(黄色;PDB:gydF4y2Ba7 s65车型gydF4y2Ba)gydF4y2Ba19gydF4y2Ba.野生型KaiC的c端未观察到电子密度gydF4y2BaSEgydF4y2BaS431E/T432A因灵活性突变,野生型KaiC缺失22个残基gydF4y2BaSEgydF4y2Ba(S431E/T432A为46)用虚线表示(突变体未显示)。gydF4y2Ba
为了验证我们的假设,我们首先测量了KaiC中的自磷酸化和核苷酸交换率gydF4y2BaRSgydF4y2Ba,这两者都依赖于KaiA在KaiABC中的存在gydF4y2BaSEgydF4y2Ba系统。我们观察到KaiC的自磷酸化率gydF4y2BaRSgydF4y2Ba这比KaiC高出约16倍gydF4y2BaSEgydF4y2BaKaiA激活gydF4y2BaSEgydF4y2Ba(6.5±1.0 hgydF4y2Ba−1gydF4y2Ba与0.40±0.02 h相比gydF4y2Ba−1gydF4y2Ba分别;无花果。gydF4y2Ba1 bgydF4y2Ba和扩展数据图。gydF4y2Ba2 a egydF4y2Ba).同样,KaiC的核苷酸交换速率更快gydF4y2BaRSgydF4y2Ba与KaiC相比gydF4y2BaSEgydF4y2Ba,即使KaiA在场gydF4y2BaSEgydF4y2Ba(18.0±1.5 hgydF4y2Ba−1gydF4y2Ba相比4.7±0.3 hgydF4y2Ba−1gydF4y2Ba分别;无花果。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba2 fgydF4y2Ba).我们的数据表明,KaiCgydF4y2BaRSgydF4y2Ba可以自行进行自磷酸化和核苷酸交换,并且比最近进化的同类更快。gydF4y2Ba
一个线圈-线圈的相互作用组装了一个KaiCgydF4y2BaRSgydF4y2BadodecamergydF4y2Ba
机械地评估KaiC在gydF4y2BakaiAgydF4y2Ba-null系统实现自磷酸化,我们转向结构生物学。KaiC的晶体结构gydF4y2BaRSgydF4y2Ba与来自蓝藻的KaiC不同,揭示了一种同十二聚体,由两个同六聚体结构域组成,由延伸的c端尾部形成的12螺旋线圈结构域连接(蛋白质数据库(PDB)标识符:gydF4y2Ba8 dbagydF4y2Ba;无花果。gydF4y2Ba1 dgydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).对KaiC中CII域的进一步检查gydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaSE / TEgydF4y2Ba(gydF4y2BaThermosynechococcus elongatusgydF4y2BaBP-1即KaiCgydF4y2BaTEgydF4y2Ba)在A环取向上有明显差异:KaiC表现为延伸构象gydF4y2BaRSgydF4y2Ba与KaiC的埋向相比较gydF4y2BaSE / TEgydF4y2Ba(无花果。gydF4y2Ba1 egydF4y2Ba).这种扩展构象在KaiA结合后的存在已经被提出gydF4y2Ba18gydF4y2Ba.这一假设是基于分别在去除A环或破坏KaiA结合后所发生的过度磷酸化和低磷酸化gydF4y2Ba18gydF4y2Ba.最近解决了夜间拟磷KaiC的冷冻- em结构gydF4y2BaSEgydF4y2Ba-S431E/T432A在压缩状态下直接显示了一个无序的a循环,不再与422循环相互作用gydF4y2Ba19gydF4y2Ba,类似于我们在KaiC中观察到的扩展A环构象gydF4y2BaRSgydF4y2Ba(无花果。gydF4y2Ba1 egydF4y2Ba).A环和422环之间相互作用的缺失(距离磷酸化位点仅10个残基)导致Ser431-Thr432的羟基与ATP的γ-磷酸之间更接近,从而促进了磷酸化转移步骤gydF4y2Ba20.gydF4y2Ba.进一步,KaiC之间的序列相似性gydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaSEgydF4y2Ba对于A环路和被认为对该环路在其埋藏方向上的稳定重要的残基(即422环路和残基438-444)小于30%(图。gydF4y2Ba1 egydF4y2Ba).总之,我们的结构和动力学数据支持这样一种观点,即暴露的A环是不依赖kaia的核苷酸交换增强的关键,因此在KaiC中发生自磷酸化gydF4y2BaRSgydF4y2Ba或者其他基于kaibc的系统。gydF4y2Ba
然后,我们质疑了线圈结构域的目的是“拉起”A环还是积极参与KaiC的核苷酸交换和自磷酸化。为了进一步了解它的作用,我们根据系统发育树和晶体学信息(KaiC)在残基Glu490上进行了截断gydF4y2BaRSgydF4y2Ba-Δcoil)(扩展数据图。gydF4y2Ba1 bgydF4y2Ba)来破坏两个六聚体之间的线圈相互作用。KaiC的晶体结构gydF4y2BaRSgydF4y2BaΔ线圈(PDB:gydF4y2Ba8 db4gydF4y2Ba;无花果。gydF4y2Ba2 a, bgydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba),其阻垢色谱图和分析超离心剖面(扩展数据图。gydF4y2Ba3得了gydF4y2Ba)显示无线圈-线圈相互作用的六聚体结构。KaiC在CII域中的核苷酸交换率gydF4y2BaRSgydF4y2Ba-Δcoil与野生型蛋白具有可比性(19.1±0.8 hgydF4y2Ba−1gydF4y2Ba18.0±1.5 hgydF4y2Ba−1gydF4y2Ba分别;扩展数据图。gydF4y2Ba3 dgydF4y2Ba).磷酸化率也相似(5.5±0.4 hgydF4y2Ba−1gydF4y2Ba7.4±0.3 hgydF4y2Ba−1gydF4y2Ba对于KaiCgydF4y2BaRSgydF4y2Ba-Δcoil和野生型分别;扩展数据图。gydF4y2Ba3 e, fgydF4y2Ba).这些结果表明,在KaiC中核苷酸交换和自磷酸化中起关键作用的是延长的A环,而不是线圈相互作用gydF4y2BaRSgydF4y2Ba.该结果还提供了其他基于kaibc的系统中缺乏线圈束的自磷酸化的潜在机制。值得注意的是,线圈束提供了额外的六聚体稳定性。详细来说,KaiCgydF4y2BaRSgydF4y2Ba在只有ADP存在的情况下,十二聚体在很长一段时间内是稳定的。gydF4y2Ba3 g hgydF4y2Ba),而KaiCgydF4y2BaSEgydF4y2Ba,在这些条件下未观察到低聚物gydF4y2Ba21gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba, KaiC的x射线结构gydF4y2BaRSgydF4y2Ba-Δcoil是在C222中解决的gydF4y2Ba1gydF4y2Ba在不对称单元中包含三个单体,ADP存在于所有活性位点。得到的电子密度图允许在Pro463之前建立模型,这表明在位置490处的截断导致了超过Pro463的柔性增强。通过电子密度可以观察到B链(青色)中Ser414 (pS414)的磷酸化gydF4y2Ba曼氏金融gydF4y2BaogydF4y2Ba- - - - - -gydF4y2BaDFgydF4y2BacgydF4y2Ba圩田图(绿色网格,3gydF4y2BaσgydF4y2Ba等高级别)。gydF4y2BabgydF4y2Ba,使用PISA软件进行装配分析gydF4y2Ba37gydF4y2Ba揭示了一个六聚体作为最可能的第四纪结构(俯视图)。gydF4y2BacgydF4y2Ba,未磷酸化KaiC的线圈结构比较gydF4y2BaRSgydF4y2Ba(深绿色和浅绿色;x射线结构)和KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E拟磷突变体(深浅蓝色;低温电子显微镜结构)。gydF4y2BadgydF4y2Ba中结构相互作用二聚体的叠加gydF4y2BacgydF4y2Ba使用链A的CII域作为参考(深色;底部)。磷酸化KaiCgydF4y2BaRSgydF4y2Ba(深绿色)与右侧对面的伙伴(浅绿色)交互,而KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E(深蓝色)与左边的伙伴(浅蓝色)交互。在未磷酸化的KaiC中,线圈结构区的疏水填料仅由丙氨酸残基和精氨酸残基的Cβ原子介导gydF4y2BaRSgydF4y2Ba,但涉及整个侧链的亮氨酸和异亮氨酸残基的拟磷结构。gydF4y2BaegydF4y2Ba,拟磷状态下的变构网络(蓝色)来自线圈(浅蓝色)通过KaiC传播gydF4y2BaRSgydF4y2BaCII结构域到活性位点(深蓝色)与未磷酸化状态(深绿色)相比(补充视频)gydF4y2Ba1gydF4y2Ba).gydF4y2BafgydF4y2Ba, KaiC的自去磷酸化gydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaRSgydF4y2Ba-Δcoil在30°C下,在4 mM ADP的存在下。磷酸化(P)蛋白和未磷酸化(U)蛋白用Zn分离gydF4y2Ba2 +gydF4y2BaPhos-tag SDS-PAGE(凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
KaiC中的长距变构网络gydF4y2BaRSgydF4y2Ba
KaiC磷酸化状态的改变已被证实是昼夜节律的中心特征gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.值得注意的是,当比较全长KaiC的未磷酸化形式时gydF4y2BaRSgydF4y2Ba(PDB:gydF4y2Ba8 dbagydF4y2Ba)及其拟磷突变体(S413E/S414E;PDB:gydF4y2Ba8 fwigydF4y2Ba扩展数据图gydF4y2Ba4 gydF4y2Ba及扩展数据表gydF4y2Ba2gydF4y2Ba),我们观察到两种不同的线圈-线圈相互作用。在磷酸化之后,线圈对通过与对面六聚体的另一个相邻链相互作用来交换伙伴,这导致了沿整个线圈传播约115 Å的寄存器移位(图2)。gydF4y2Ba2摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba).在拟磷状态下,寄存器包含更大的疏水残基,导致比去磷酸化形式更稳定的相互作用(图。gydF4y2Ba二维gydF4y2Ba和扩展数据图。gydF4y2Ba3 ggydF4y2Ba).进一步研究了KaiC的c端残基gydF4y2BaRSgydF4y2Ba-S413E/S414E与对面六聚体的CII结构域相互作用,而野生型结构中最后30个残基缺乏电子密度表明其在去磷酸化状态下具有更强的灵活性。我们发现这些线圈结构域的构象变化似乎是通过一个远程变构网络耦合到磷酸化位点的。当蛋白质被磷酸化或没有磷酸基时,Ser413、Ser414、Trp419、Val421、Tyr436、Leu438、Val449和Arg450残基的旋转互移状态一致地指向核苷酸结合位点(图4)。gydF4y2Ba2 egydF4y2Ba扩展数据图gydF4y2Ba5 dgydF4y2Ba及补充视频gydF4y2Ba1gydF4y2Ba).我们认为核苷酸与磷酸化残基的接近促进了更有效的磷酸化转移。因此,我们通过实验确定了线圈结构域对KaiC的自脱磷酸化速率的影响gydF4y2BaRSgydF4y2Ba.野生型蛋白去磷酸化相对较快(观察速率常数= 11.5±0.8 h)gydF4y2Ba−1gydF4y2Ba)在只有ADP存在的情况下。相比之下,KaiC的去磷酸化很少gydF4y2BaRSgydF4y2Ba-Δ线圈(无花果。gydF4y2Ba2 fgydF4y2Ba和扩展数据图。gydF4y2Ba3我gydF4y2Ba),其变构传播被中断(扩展数据图。gydF4y2Ba5 dgydF4y2Ba).与这种由线圈结构域介导的加速脱磷酸化速率一致,我们的晶体学数据显示KaiC的Ser414上有一个磷酸基gydF4y2BaRSgydF4y2Ba-Δcoil但对野生型蛋白没有作用(图。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba5 dgydF4y2Ba).gydF4y2Ba
atp - adp比率重置时钟gydF4y2Ba
值得注意的是,KaiCgydF4y2BaRSgydF4y2Ba尽管由于其延伸的A环构象而对磷酸化具有组成活性,但它可以自行去磷酸化。在规范中gydF4y2BakaiABCgydF4y2BaKaiB和KaiC之间的相互作用需要提供一个新的结合界面,将KaiA从其激活的结合位点隔离,从而促进机体在最佳温度下的自去磷酸化gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.因此,我们试图了解KaiC是否gydF4y2BaRSgydF4y2Ba系统是否能振荡以及KaiB是否有调节作用gydF4y2BaRSgydF4y2Ba在这个过程中。比较KaiC的体外磷酸化状态gydF4y2BaRSgydF4y2BaKaiB的缺席和存在gydF4y2BaRSgydF4y2Ba在KaiB存在的情况下,显示出初始的快速磷酸化,然后是振荡样模式gydF4y2BaRSgydF4y2Ba(以下简称KaiBC)gydF4y2BaRSgydF4y2Ba),而KaiCgydF4y2BaRSgydF4y2Ba仅被磷酸化(图;gydF4y2Ba3 a, bgydF4y2Ba).值得注意的是,与KaiB反应过程中ATP的消耗gydF4y2BaRSgydF4y2Ba显著高于对照组(图;gydF4y2Ba3gydF4y2Ba).如上所述,KaiCgydF4y2BaRSgydF4y2Ba在只有ADP存在的情况下,也会完全去磷酸化(图。gydF4y2Ba2 fgydF4y2Ba).这些结果表明KaiC的磷酸化状态gydF4y2BaRSgydF4y2Ba和观测到的振荡半周期(图;gydF4y2Ba3 a, bgydF4y2Ba)可能与atp - adp比值的变化有关。我们推测,这可能构成重置计时器的环境线索。为了验证我们的假设,在KaiBC完全去磷酸化后加入atp回收系统gydF4y2BaRSgydF4y2Ba.正如预测的那样,KaiCgydF4y2BaRSgydF4y2Ba能够重新启动循环并再次磷酸化(扩展数据图。gydF4y2Ba6gydF4y2Ba).我们注意到,在体内,atp - adp比值不会像在体外实验中那样发生显著变化,因为核苷酸稳态受到严格调控。模拟白天和黑夜的周期gydF4y2BaR。gydF4y2BasphaeroidesgydF4y2Ba,我们在保持ATP- adp比例不变的情况下重复实验(白天主要是ATP,由于光合作用,而夜间ATP- adp比例为25:75%)gydF4y2Ba27gydF4y2Ba.在高ATP存在的情况下(即模拟白天),KaiCgydF4y2BaRSgydF4y2Ba保持单或双磷酸化(图;gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba6 bgydF4y2Ba),与KaiB无关gydF4y2BaRSgydF4y2Ba.相比之下,恒定的25:75%的atp - adp比例(即模拟夜间时间)会导致更高比例的去磷酸化KaiCgydF4y2BaRSgydF4y2BaKaiB在场gydF4y2BaRSgydF4y2Ba(无花果。gydF4y2Ba3 cgydF4y2Ba).此外,当atp - adp比值翻转到模拟白天时,KaiCgydF4y2BaRSgydF4y2Ba能够再次磷酸化(图;gydF4y2Ba3 cgydF4y2Ba在28小时左右)。我们的数据支持KaiBC的磷酸化行为gydF4y2BaRSgydF4y2Ba强烈依赖于atp - adp比,证明KaiB的物理结合gydF4y2BaRSgydF4y2Ba结果KaiC水平较高gydF4y2BaRSgydF4y2Ba在夜间去磷酸化。gydF4y2Ba
一个gydF4y2Ba, 3.5 μM KaiC的SDS-PAGE凝胶gydF4y2BaRSgydF4y2Ba在3.5 μM KaiB不存在(上)和存在(下)时,ATP为4 mMgydF4y2BaRSgydF4y2Ba在35°C, ATP的百分比表示在特定的时间点。gydF4y2BabgydF4y2BaKaiC的单、双磷酸化gydF4y2BaRSgydF4y2Ba在没有KaiB(灰圈)或有KaiB(红钻)的情况下进行反应gydF4y2BaRS。gydF4y2BacgydF4y2Ba3.5 μM的磷酸化-脱磷酸化循环使KaiC磷酸化gydF4y2BaRSgydF4y2Ba在3.5 μM KaiB存在和不存在的情况下gydF4y2BaRSgydF4y2Ba在恒定的高ATP- adp比值(4 mM)下模拟白天,在30°C下模拟夜间(特定时间点ATP的确切百分比)。U, S和D在gydF4y2Ba一个gydF4y2Ba而且gydF4y2BacgydF4y2Ba代表KaiC的未磷酸化、单磷酸化(Ser413或Ser414)和双磷酸化状态gydF4y2BaRSgydF4y2Ba,凝胶源数据见补充图。gydF4y2Ba1gydF4y2Ba).gydF4y2BadgydF4y2Ba,野生型KaiC的atp酶活性gydF4y2BaRSgydF4y2BaKaiB的缺席和存在gydF4y2BaRSgydF4y2Ba, KaiCgydF4y2BaRSgydF4y2Ba-E62Q/E63Q在KaiB不存在和存在的情况下gydF4y2BaRSgydF4y2Ba、KaiCgydF4y2BaRSgydF4y2Ba-E302Q/E303Q在KaiB缺席和存在的情况下gydF4y2BaRSgydF4y2Ba30°C。柱状图显示平均值±s.d。从三个重复。gydF4y2BaegydF4y2Ba的时间依赖性自去磷酸化gydF4y2Ba32gydF4y2BaP-labelled KaiCgydF4y2BaRSgydF4y2Ba在20 μM KaiB存在下与ADP结合gydF4y2BaRSgydF4y2Ba和4 mM ADP在30°C显示磷酸化gydF4y2Ba32gydF4y2BaP-KaiCgydF4y2BaRSgydF4y2Ba,gydF4y2Ba32gydF4y2BaP-ATP和游离的gydF4y2Ba32gydF4y2Baπ。用薄层色谱法对反应产物进行分离。gydF4y2BafgydF4y2Ba,磷酸化的衰变gydF4y2Ba32gydF4y2BaP-KaiCgydF4y2BaRSgydF4y2Ba与4 mM ADP结合,不存在KaiB(灰色圆圈)和存在KaiB(红钻)gydF4y2BaRSgydF4y2Ba在30°C时,由放射自显影定量获得(扩展数据图。gydF4y2Ba7gydF4y2Ba).gydF4y2BaggydF4y2Ba,核苷酸交换3.5 μM KaiCgydF4y2BaRSgydF4y2Ba(灰色痕迹)和3.5 μM KaiCgydF4y2BaRSgydF4y2Ba与30 μM KaiB配合物gydF4y2BaRSgydF4y2Ba(红色虚线)在ATP存在的情况下。有代表性的痕迹显示,拟合参数(平均值±s.d)从三个重复测量获得。gydF4y2Ba
接下来我们研究了在KaiC中观察到的加速的atp酶活性gydF4y2BaRSgydF4y2Ba复合物形成后。KaiC报告atp酶活性gydF4y2BaSEgydF4y2Ba低(大约每天15个ATP分子,每个KaiC分子gydF4y2BaSEgydF4y2Ba),并被认为是昼夜节律振荡缓慢的原因gydF4y2Ba28gydF4y2Ba.KaiCgydF4y2BaRSgydF4y2Ba单独表现出明显高于KaiC的atp酶速率gydF4y2BaSEgydF4y2Ba,通过与KaiB的结合进一步增强gydF4y2BaRSgydF4y2Ba(208±19和1557±172 ATP分子每天每KaiCgydF4y2BaRSgydF4y2Ba分别;在图中留下两个棒。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba6 c ggydF4y2Ba).此外,KaiCgydF4y2BaRSgydF4y2Ba其atp酶活性不表现出温度补偿(温度系数gydF4y2Ba问gydF4y2Ba10克ydF4y2Ba约为1.9;扩展数据图。gydF4y2Ba6摄氏度gydF4y2Ba),这是KaiC中的一个特性gydF4y2BaSEgydF4y2Ba并被认为是自我维持节奏的先决条件gydF4y2Ba28gydF4y2Ba.偏离统一为gydF4y2Ba问gydF4y2Ba10克ydF4y2Ba与我们之前的观察相一致,KaiBCgydF4y2BaRSgydF4y2Ba系统不是一个真正的昼夜节律振荡器,而是一个沙漏计时器(图。gydF4y2Ba3 bgydF4y2Ba).gydF4y2Ba
KaiB的调控作用gydF4y2BaRSgydF4y2Ba
详细介绍了如何绑定KaiB的机制gydF4y2BaRSgydF4y2Ba在CI域,变构作用影响KaiC的自脱磷酸化gydF4y2BaRSgydF4y2Ba在CII领域仍不清楚。有三种可能的情况可以解释这一点:(1)KaiBgydF4y2BaRSgydF4y2Ba结合刺激磷酸化基从pSer转移回ADP(扩展数据图。gydF4y2Ba7一个gydF4y2Ba);(2) KaiBgydF4y2BaRSgydF4y2Ba结合增加了活性位点ATP的水解速率(扩展数据图。gydF4y2Ba8gydF4y2Ba);(3) KaiBgydF4y2BaRSgydF4y2Ba结合加速CII结构域的核苷酸交换(扩展数据图。gydF4y2Ba8 egydF4y2Ba).为了区分这些可能性,我们进行了放射性实验来跟踪核苷酸相互转换。我们还测量了野生型KaiC的atp酶活性gydF4y2BaRSgydF4y2Ba以及在CI或CII结构域没有atp酶活性的突变形式,并通过测量mant-ATP的荧光来量化核苷酸交换率。首先,我们检测到快速,瞬态gydF4y2Ba32gydF4y2BaP-ATP的形成在我们的放射性实验中从gydF4y2Ba32gydF4y2BaP-phosphorylated KaiCgydF4y2BaRSgydF4y2Ba,这是由于其ATP合酶活性在CII结构域(图。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba7罪犯gydF4y2Ba).观察到的磷酸化转移速率与KaiB无关gydF4y2BaRSgydF4y2Ba(观察速率常数= 12.0±1.7 hgydF4y2Ba−1gydF4y2Ba15.4±1.7 hgydF4y2Ba−1gydF4y2Ba分别在它不在的时候和在它存在的时候;无花果。gydF4y2Ba3 fgydF4y2Ba),与凝胶电泳实验测定的速率(11.0±0.8 hgydF4y2Ba−1gydF4y2Ba11.5±0.8 hgydF4y2Ba−1gydF4y2Ba有或没有KaiBgydF4y2BaRSgydF4y2Ba分别;扩展数据图。gydF4y2Ba7 e, fgydF4y2Ba).我们的实验数据证实了KaiCgydF4y2BaRSgydF4y2Ba通过ATP合酶机制进行去磷酸化,类似于KaiC的观察结果gydF4y2BaSEgydF4y2Ba(ref。gydF4y2Ba29gydF4y2Ba).KaiB不会加速实际的磷酸化转移反应,这从来不是限制速率的步骤。由于我们无法在ADP存在的情况下稳定第一个磷酸化位点(Ser414),这里报道的速率只对应于Ser413的去磷酸化。其次,为了反褶积CI和CII结构域对所观察到的atp酶活性的贡献,我们测量了来自KaiC的ADP产生gydF4y2BaRSgydF4y2Ba在CI结构域(KaiC)中取消水解的突变体gydF4y2BaRSgydF4y2Ba-E62Q/E63Q)或CII域(KaiCgydF4y2BaRSgydF4y2Ba-E302Q / E303Q)。野生型KaiCgydF4y2BaRSgydF4y2Ba, KaiB的结合gydF4y2BaRSgydF4y2Ba导致atp酶活性增加7.5倍,这两个结构域都受到影响,并对总体效果产生了附加作用(CI为3倍,CII至少为1.7倍)(图2)。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba8罪犯gydF4y2Ba).值得注意的是,CII结构域的翻倍增加代表了诱导产生KaiC的突变的下限gydF4y2BaRSgydF4y2Ba-E62Q/E63Q干扰KaiBgydF4y2BaRSgydF4y2Ba绑定,如前面报道的KaiCgydF4y2BaSEgydF4y2Ba(ref。gydF4y2Ba30.gydF4y2Ba).第三,我们对核苷酸交换的测量表明,这个速率也不受KaiB的影响gydF4y2BaRSgydF4y2Ba结合(19.8±1.8 hgydF4y2Ba−1gydF4y2Ba18.0±1.5 hgydF4y2Ba−1gydF4y2Ba有或没有KaiBgydF4y2BaRSgydF4y2Ba分别;无花果。gydF4y2Ba3 ggydF4y2Ba).由于CI区核苷酸结合位点附近没有色氨酸残留,只能测定CII区交换率。值得注意的是,KaiB存在时,荧光振幅的变化较小gydF4y2BaRSgydF4y2Ba,这说明即使KaiB的结合gydF4y2BaRSgydF4y2Ba不加速核苷酸交换,它似乎诱导CII结构域的构象重排,特别是在较高的温度下(图。gydF4y2Ba3 ggydF4y2Ba和扩展数据图。gydF4y2Ba8 f-hgydF4y2Ba).gydF4y2Ba
KaiBC的结构gydF4y2BaRSgydF4y2Ba复杂的gydF4y2Ba
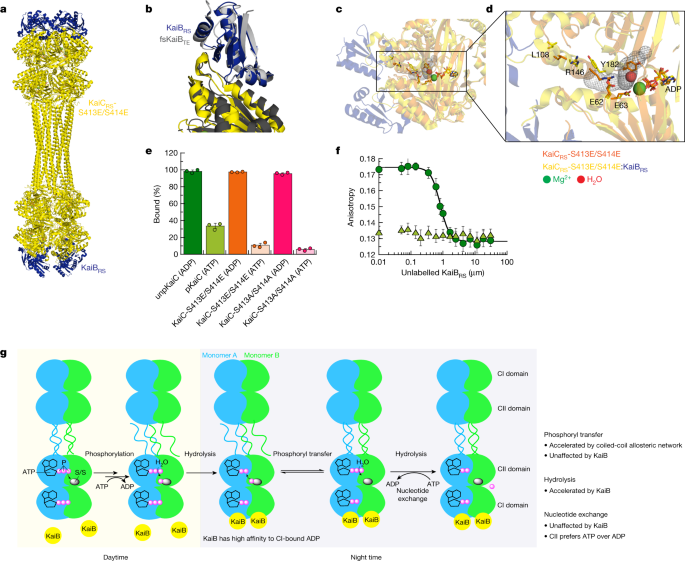
阐明KaiC atp酶活性增强的结构基础gydF4y2BaRSgydF4y2BaKaiB后gydF4y2BaRSgydF4y2Ba结合,我们解决了KaiC的冷冻- em结构gydF4y2BaRSgydF4y2Ba独自一人(PDB:gydF4y2Ba8 fwigydF4y2Ba),并与KaiB复合gydF4y2BaRSgydF4y2Ba(PDB:gydF4y2Ba8 fwjgydF4y2Ba(扩展数据表gydF4y2Ba2gydF4y2Ba).十二KaiBgydF4y2BaRSgydF4y2Ba分子(溶液中的单体;扩展数据图。gydF4y2Ba9gydF4y2Ba)绑定到KaiC的CI域gydF4y2BaRSgydF4y2Ba-S413E/S414E十二聚物gydF4y2Ba4得了gydF4y2Ba和扩展数据图。gydF4y2Ba9 bgydF4y2Ba).KaiB的束缚态gydF4y2BaRSgydF4y2Ba采用与KaiB相同的折叠开关构象gydF4y2BaTEgydF4y2Ba(ref。gydF4y2Ba25gydF4y2Ba),并提出这是规范的结合胜任态(图。gydF4y2Ba4 bgydF4y2Ba).KaiB绑定后gydF4y2BaRSgydF4y2Ba时,CI-CI接口松动(图;gydF4y2Ba4摄氏度gydF4y2Ba),从而形成一个隧道,将溶剂本体与活性区水解水的位置连接起来(图2)。gydF4y2Ba4 dgydF4y2Ba和扩展数据图。gydF4y2Ba9 cgydF4y2Ba).还有其他证据表明CI域内的相互作用减弱。首先,KaiBgydF4y2BaRSgydF4y2Ba绑定到任意一个KaiCgydF4y2BaRSgydF4y2Ba-CI域(扩展数据图。gydF4y2Ba10gydF4y2Ba)或KaiCgydF4y2BaRSgydF4y2Ba-Δcoil(即缺少c端扩展;扩展数据图。gydF4y2Ba10 bgydF4y2Ba)导致六聚体KaiC的分解gydF4y2BaRSgydF4y2Ba结构成单体。相比之下,全长KaiCgydF4y2BaRSgydF4y2Ba与KaiB结合后保持寡聚状态gydF4y2BaRSgydF4y2Ba,这可能是由于线圈相互作用提供的稳定。第二,熔化温度降低(gydF4y2BaTgydF4y2Ba米gydF4y2Ba)gydF4y2BaRSgydF4y2BaKaiBgydF4y2BaRSgydF4y2Ba浓度(扩展数据图。gydF4y2Ba10 cgydF4y2Ba).邻近的KaiB之间没有相互作用gydF4y2BaRSgydF4y2Ba复合物中的分子(扩展数据图。gydF4y2Ba9 bgydF4y2Ba),说明KaiB存在非合作组装gydF4y2BaRSgydF4y2Ba对KaiCgydF4y2BaRSgydF4y2Ba.这个结果与KaiBC观察到的结果相反gydF4y2BaSEgydF4y2Ba和KaiBCgydF4y2BaTEgydF4y2Ba复合物gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba, KaiC的Cryo-EM结构gydF4y2BaRSgydF4y2Ba-S413E/S414E(黄色)与KaiB复合体gydF4y2BaRSgydF4y2Ba(蓝色)(PDB:gydF4y2Ba8 fwjgydF4y2Ba).gydF4y2BabgydF4y2Ba, KaiC的叠加gydF4y2BaRSgydF4y2Ba-S413E/S414E(黄色)与KaiB结合gydF4y2BaRSgydF4y2Ba(蓝色)(PDB:gydF4y2Ba8 fwjgydF4y2Ba)及KaiCgydF4y2BaTEgydF4y2Ba-S413E(深灰色)绑定到fsKaiBgydF4y2BaTEgydF4y2Ba(KaiB的折叠开关,结合胜任态gydF4y2BaTEgydF4y2Ba;浅灰色)(PDB:gydF4y2Ba5 jwqgydF4y2Ba)gydF4y2Ba26gydF4y2Ba.gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, KaiB的结合gydF4y2BaRSgydF4y2Ba(蓝色)创建一个隧道(灰色网格),使水到达催化位置(红色球体)ATP水解在CI域。gydF4y2BaegydF4y2Ba, KaiC野生型与突变型的结合gydF4y2BaRSgydF4y2Ba他标记的KaiBgydF4y2BaRSgydF4y2Ba在ADP或atp回收系统存在的情况下,在25°C。柱状图显示平均值±s.d。从三个重复。gydF4y2BafgydF4y2Ba,未标记KaiB的荧光各向异性gydF4y2BaRSgydF4y2Ba竞争性地取代KaiBgydF4y2BaRSgydF4y2Ba-6IAF(其中6IAF为荧光团)来自未磷酸化的KaiCgydF4y2BaRSgydF4y2Ba存在ADP(深绿色圆圈)和磷酸化的KaiCgydF4y2BaRSgydF4y2Ba在30°C的atp回收系统(浅绿色三角形)的存在下。计算了10次重复测量的平均各向异性和标准误差。gydF4y2BaggydF4y2Ba, KaiC裸露机理示意图gydF4y2BaRSgydF4y2Ba由线圈-线圈相互作用和KaiB调节gydF4y2BaRSgydF4y2Ba在CI和CII领域。gydF4y2Ba
此外,我们注意到KaiC的拟磷变体中存在kaib结合结构gydF4y2BaRSgydF4y2Ba(无花果。gydF4y2Ba4 c, dgydF4y2Ba)及KaiCgydF4y2BaSEgydF4y2Ba(ref。gydF4y2Ba26gydF4y2Ba)在它们的CI域中具有ADP边界。这一结果表明,水解后状态也是KaiB的结合能力状态gydF4y2BaRSgydF4y2Ba.为了验证这一假设,一个his标记的KaiBgydF4y2BaRSgydF4y2Ba蛋白被用于下拉实验,以检测其与KaiC野生型和突变型的物理相互作用gydF4y2BaRSgydF4y2Ba与ADP或ATP结合。几乎所有KaiBgydF4y2BaRSgydF4y2Ba与adp结合的KaiCgydF4y2BaRSgydF4y2Ba,而不到30%以atp结合形式共洗脱,无论磷酸化状态如何(图2)。gydF4y2Ba4 egydF4y2Ba和扩展数据图。gydF4y2Ba10 d, egydF4y2Ba).配合物的形成与atp - adp比成反比(扩展数据图。gydF4y2Ba10 fgydF4y2Ba).我们进行了荧光各向异性竞争实验,以获得更定量的描述KaiC之间的结合相互作用gydF4y2BaRSgydF4y2Ba和KaiBgydF4y2BaRSgydF4y2Ba.高度相似的解离常数(gydF4y2BaKgydF4y2BadgydF4y2Ba)的值为未磷酸化的野生型KaiCgydF4y2BaRSgydF4y2Ba(无花果。gydF4y2Ba4 fgydF4y2Ba)及其拟磷形式(扩展数据图。gydF4y2Ba10克gydF4y2Ba)与ADP结合(分别为0.42±0.03 μ M和0.79±0.06 μ M)。atp结合磷酸化野生型KaiC没有得到可测量的结合曲线gydF4y2BaRSgydF4y2Ba(无花果。gydF4y2Ba4 fgydF4y2Ba)或为KaiC服务gydF4y2BaRSgydF4y2Ba-S413E/S414E(扩展数据图gydF4y2Ba10克gydF4y2Ba)与atp循环系统,这可能是由于复合物存在的比例较小。我们的数据表明,CI结构域的水解后状态是KaiB的关键gydF4y2BaRSgydF4y2Ba而KaiC的磷酸化状态gydF4y2BaRSgydF4y2Ba只有边际效应。gydF4y2Ba
总之,我们演示了KaiB的结合gydF4y2BaRSgydF4y2Ba在解后状态的CI区域,促进KaiC去磷酸化后瞬时形成的ATP的水解gydF4y2BaRSgydF4y2Ba在CII域(图;gydF4y2Ba4 ggydF4y2Ba).我们的荧光实验(图;gydF4y2Ba3 ggydF4y2Ba和扩展数据图。gydF4y2Ba8 fgydF4y2Ba)检测到KaiB后CII结构域发生构象变化gydF4y2BaRSgydF4y2Ba结合,但我们没有观察到冷冻- em结构的主要结构变化。基于荧光振幅的温度依赖性(扩展数据图。gydF4y2Ba8 fgydF4y2Ba),我们推测无法检测构象差异可能是由于温度较低。由于CII域更倾向于结合ATP而不是ADP(扩展数据图)。gydF4y2Ba10 hgydF4y2Ba), KaiB刺激CII结构域ATP水解gydF4y2BaRSgydF4y2Ba尤其重要的是保留KaiCgydF4y2BaRSgydF4y2Ba在夜间处于去磷酸化状态。在此期间,外源性atp - adp比值保持足够高,否则会导致atp在CII活性位点的结合(图2)。gydF4y2Ba3 cgydF4y2Ba和扩展数据图。gydF4y2Ba6 bgydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
的KaiBCgydF4y2BaRSgydF4y2Ba这里研究的系统代表了一种原始的沙漏计时机械,其机制提供了对更进化的昼夜节律振荡器如KaiABC的深入了解。十二元的KaiCgydF4y2BaRSgydF4y2Ba由于其延伸的c端尾部与相反的六聚体形成线圈束,显示出本构激酶活性。这种结构引出了类似于KaiAC中暴露的a环构象gydF4y2BaSEgydF4y2Ba,自磷酸化在半小时内发生。在KaiABC中gydF4y2BaSEgydF4y2Ba从未磷酸化到双磷酸化的KaiC的转变发生在大约12小时内,并且KaiA的出现完成了昼夜节律的前半段的微调gydF4y2BaSEgydF4y2Ba在进化过程中。第二个时钟蛋白KaiB在两个系统中以相同的折叠开关状态结合CI结构域。这种相互作用由KaiABC中的磷酸化状态控制gydF4y2BaSEgydF4y2Ba系统,其唯一功能是隔离KaiAgydF4y2BaSEgydF4y2Ba而KaiB的结合直接加速了KaiBC中atp酶的活性gydF4y2BaRSgydF4y2Ba不管磷酸化状态如何。的KaiBCgydF4y2BaRSgydF4y2Ba系统需要一个atp - adp浓度的环境开关来重置时钟。因此,当有机体中的核苷酸浓度固有地波动时,系统遵循昼夜时间表。相比之下,自持振荡器KaiABCgydF4y2BaSEgydF4y2Ba在很宽的核苷酸浓度范围内保持功能,并通过改变其磷酸化周期和振幅来响应atp - adp比率的变化,以保持昼夜循环gydF4y2Ba33gydF4y2Ba.gydF4y2Ba
新报道的KaiC结构褶皱利用了多功能线圈结构作为调节KaiC的远程变构网络的一部分gydF4y2BaRSgydF4y2Ba去磷酸化。自然界利用线圈结构域的构象变化来发挥各种调节功能gydF4y2Ba34gydF4y2Ba,包括运动蛋白动力蛋白在细胞沿肌动蛋白丝运输货物的活动gydF4y2Ba12gydF4y2Ba.类似的寄存器移位,虽然在只有两个螺旋形成的线圈-线圈相互作用中,在动力蛋白运动中使用。考虑到这个简单的七角重复序列出现了多次,并且在生命的所有王国都能找到gydF4y2Ba35gydF4y2Ba,这是趋同进化的一个例子。gydF4y2Ba
方法gydF4y2Ba
KaiC和KaiB表达载体的构建gydF4y2Ba
野生型KaiCgydF4y2BaRSgydF4y2Ba(基因库标识符:gydF4y2BaACM04290.1gydF4y2Ba)及KaiBgydF4y2BaRSgydF4y2Ba(基因库:gydF4y2BaWP_002725098.1gydF4y2Ba)gydF4y2BaR。gydF4y2BasphaeroidesgydF4y2Ba菌株KD131/KCTC 12085(等效:gydF4y2BaCereibacter sphaeroidesgydF4y2Ba本文所使用的菌株KD131的结构是从GenScript (Supplementary TablegydF4y2Ba1gydF4y2Ba).KaiC的密码子优化质粒gydF4y2BaRSgydF4y2Ba和KaiBgydF4y2BaRSgydF4y2Ba亚克隆到pETM-41载体的NcoI/KpnI位点。使用QuikChange II位点定向突变试剂盒(Agilent Technologies)生成单突变体、双突变体和截断型KaiCgydF4y2BaRSgydF4y2Ba.删减后的KaiCgydF4y2BaRSgydF4y2Ba(KaiCgydF4y2BaRSgydF4y2Ba-Δcoil和KaiCIgydF4y2BaRSgydF4y2Ba)通过在KaiC中引入停止密码子生成gydF4y2BaRSgydF4y2Ba野生型质粒。所有引物均从Genewiz订购(补充表)gydF4y2Ba2gydF4y2Ba).目标KaiC的存在gydF4y2BaRSgydF4y2BaGenewiz使用同一公司订购的引物进行DNA测序,确认了质粒中的突变(见补充表)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
两个KaiCgydF4y2BaSEgydF4y2Ba和KaiAgydF4y2BaSEgydF4y2Ba质粒是e。K。奥谢。按照先前描述的程序进行表达和纯化gydF4y2Ba6gydF4y2Ba.gydF4y2Ba
KaiC的表达与纯化gydF4y2BaRSgydF4y2Ba和KaiBgydF4y2BaRSgydF4y2Ba从gydF4y2BaR。gydF4y2BasphaeroidesgydF4y2Ba
KaiCgydF4y2BaRSgydF4y2Ba, KaiCgydF4y2BaRSgydF4y2Ba突变体和KaiBgydF4y2BaRSgydF4y2Ba表达为gydF4y2Ba大肠杆菌gydF4y2BaBL21(DE3)细胞(New England Biolabs)含有pETM-41质粒gydF4y2BakaiCgydF4y2BaRSgydF4y2Ba或gydF4y2BakaiBgydF4y2BaRSgydF4y2Ba基因。从新制备的转化板上取3个菌落接种到1升含50 μg ml的TB培养基中gydF4y2Ba1gydF4y2Ba卡那霉素。培养条件为25°C, 220转/分。48小时无IPTG诱导(渗漏表达)。以4200转/分的离心速度将细胞制成颗粒。在4°C下保存15分钟,并在- 80°C保存。gydF4y2Ba
KaiC冷冻细胞颗粒gydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaRSgydF4y2Ba突变体重悬至裂解液缓冲液(缓冲液AgydF4y2Bac - rgydF4y2Ba)含有1× edta不含蛋白酶抑制剂鸡尾酒(赛默飞雪科学公司),DNAse I (Sigma Aldrich)和溶菌酶(Sigma Aldrich),裂解物在冰上超声10-15分钟(开20秒,关30秒,输出功率小于40%),然后在18000转/分离心。在4°C浸泡45分钟,以清除细胞碎片。裂解液经0.45 μm过滤器过滤,然后加载在HisTrap HP预包装的Ni-sepharose柱(Cytiva)上,预平衡缓冲液agydF4y2Bac - rgydF4y2Ba0.5 ml mingydF4y2Ba1gydF4y2Ba.用A缓冲液清洗色谱柱gydF4y2Bac - rgydF4y2Ba1ml mingydF4y2Ba1gydF4y2Ba直到紫外线吸光度恢复到基线。然后用15%的缓冲液B清洗杂质gydF4y2Bac - rgydF4y2Ba,用50%缓冲液B洗脱蛋白gydF4y2Bac - rgydF4y2Ba.洗脱物用1.5倍透析缓冲液稀释gydF4y2Bac - rgydF4y2Ba然后将内部制备的his标记TEV蛋白酶(1:10,TEVP:KaiCgydF4y2BaRSgydF4y2Ba摩尔比)去除HisgydF4y2Ba6gydF4y2Ba-来自KaiC的mbp标签gydF4y2BaRSgydF4y2Ba(野生型和突变型)在4°C的6-8 kDa蛇皮透析管(赛默飞世尔科学公司)中过夜,与透析缓冲液交换gydF4y2Bac - rgydF4y2Ba.裂解KaiCgydF4y2BaRSgydF4y2Ba经1 μm过滤器过滤,再次以0.5 ml mingydF4y2Ba1gydF4y2Ba去除His标记的TEV蛋白酶,HisgydF4y2Ba6gydF4y2Ba-MBP标记和未裂解蛋白。使用Millipore Amicon Ultra-15离心过滤装置(截止量为10 kDa)对流过的液体进行浓缩,然后立即通过HiPrep Sephacryl S-400 HR柱(Cytiva),该柱与C缓冲液预平衡gydF4y2Bac - rgydF4y2Ba.在62.5 kDa的Bis-Tris 4-12%梯度SDS-PAGE凝胶(Genscript)上,用单条带纯化蛋白至均匀性。所有蛋白质纯化步骤均在4°C或冰上完成。在−80°C储存之前,对蛋白质进行搅拌和速冻,直到进一步使用。使用Microplate BCA蛋白检测试剂盒(Thermo Fisher Scientific)在SpectraMax MiniMax 300成像细胞仪上以BSA为标准曲线测量蛋白浓度。典型的KaiC产量gydF4y2BaRSgydF4y2Ba(野生型和突变型)为20 ~ 40 mg lgydF4y2Ba1gydF4y2Ba的文化。gydF4y2Ba
测试纯化后的KaiCgydF4y2BaRSgydF4y2Ba有任何atp酶污染,Q-sepharose HP柱(Cytiva)预平衡缓冲DgydF4y2Bac - rgydF4y2Ba在最后的HiPrep Sephacryl S-400 HR列之前使用。用5 CV从0到100%的缓冲液E线性梯度洗脱该蛋白gydF4y2Bac - rgydF4y2Ba.使用Q-sepharose HP柱纯化的蛋白质样品的atp酶活性与不使用该额外纯化步骤的样品相同。缓冲一个gydF4y2Bac - rgydF4y2Ba包括50mm Tris-base (pH 7.5), 250mm NaCl, 10mm咪唑,2mm TCEP, 5mm MgClgydF4y2Ba2gydF4y2Ba, 1mm ATP和10%甘油(v/v)。缓冲BgydF4y2Bac - rgydF4y2Ba包括50mm Tris-base (pH 7.5), 250mm NaCl, 500mm咪唑,2mm TCEP, 5mm MgClgydF4y2Ba2gydF4y2Ba, 1mm ATP和10%甘油(v/v)。透析gydF4y2Bac - rgydF4y2Ba包括50mm Tris-base (ph7.0), 50mm NaCl, 2mm TCEP, 5mm MgClgydF4y2Ba2gydF4y2Ba, 1mm ATP和10%甘油(v/v)。缓冲CgydF4y2Bac - rgydF4y2Ba包括50mm Tris-base (ph7.0), 50mm NaCl, 2mm TCEP, 5mm MgClgydF4y2Ba2gydF4y2Ba, 1mm ATP和10%甘油(v/v)。缓冲DgydF4y2Bac - rgydF4y2Ba由50mm Tris-base (ph7.0), 2mm TCEP, 5mm MgCl组成gydF4y2Ba2gydF4y2Ba, 1mm ATP和10%甘油(v/v)。缓冲EgydF4y2Bac - rgydF4y2Ba包括50mm Tris-base (ph7.0), 1m NaCl, 2mm TCEP, 5mm MgClgydF4y2Ba2gydF4y2Ba, 1mm ATP和10%甘油(v/v)。gydF4y2Ba
KaiB的纯化gydF4y2BaRSgydF4y2Ba和KaiC相似吗gydF4y2BaRSgydF4y2Ba,但略有修改,如下所示。超声和离心去除细胞碎片后,裂解液经0.22 μm过滤器过滤,然后通过HisTrap HP预填充Ni Sepharose柱,缓冲液a预平衡gydF4y2BaB-RSgydF4y2Ba.用A缓冲液清洗色谱柱gydF4y2BaB-RSgydF4y2Ba直到紫外线吸光度恢复到基线。用5%缓冲液B清洗杂质gydF4y2BaB-RSgydF4y2Ba,用50%缓冲液B洗脱蛋白gydF4y2BaB-RSgydF4y2Ba.用Amicon搅拌细胞(Millipore Sigma)将融合蛋白浓缩至约30 ml,截止时间为10 kDa。加入内部制备的his标记TEV蛋白酶,融合蛋白在3.5 kDa透析盒中4°C裂解过夜,并与透析盒交换gydF4y2BaB-RSgydF4y2Ba缓冲区。裂开的KaiBgydF4y2BaRSgydF4y2Ba通过HisTrap HP预包装的Ni-sepharose柱,并使用Millipore Amicon Ultra-15离心过滤装置(3.5 kDa截止)浓缩至约10 ml。然后将蛋白质样本加载到26/60 Superdex S75凝胶过滤柱(Cytiva)上,该柱预先与C缓冲液平衡gydF4y2BaB-RSgydF4y2Ba4°C。洗脱后的蛋白质被装载到预先与缓冲液D平衡的Q-sepharose HP柱上gydF4y2BaB-RSgydF4y2Ba去除atp酶污染。蛋白质在流经时被冲洗掉了。从0到100%缓冲E的梯度gydF4y2BaB-RSgydF4y2Ba通过Q-sepharose HP柱,以确保没有KaiBgydF4y2BaRSgydF4y2Ba被绑在柱子上。在10.3 kDa的Bis-Tris 4-12%梯度SDS-PAGE凝胶上,用单条带纯化蛋白至均一性。在−80°C储存之前,将蛋白质搅拌并快速冷冻,直到使用。使用Microplate BCA蛋白检测试剂盒(Thermo Fisher Scientific)在SpectraMax MiniMax 300成像细胞仪上以BSA为标准曲线测量蛋白浓度。KaiB的典型产量gydF4y2BaRSgydF4y2Ba30-40 mg lgydF4y2Ba1gydF4y2Ba的文化。gydF4y2Ba
缓冲一个gydF4y2BaB-RSgydF4y2Ba由50mm Tris-base (pH 7.5), 250mm NaCl, 10mm咪唑,2mm TCEP和10%甘油(v/v)组成。缓冲BgydF4y2BaB-RSgydF4y2Ba由50mm Tris-base (pH 7.5), 250mm NaCl, 500mm咪唑,2mm TCEP和10%甘油(v/v)组成。透析gydF4y2BaB-RSgydF4y2Ba含有50 mM Tris-base (pH 7.5), 250 mM NaCl, 2 mM TCEP和10%甘油(v/v)。缓冲CgydF4y2BaB-RSgydF4y2Ba由50mm Tris-base (pH 7.5), 50mm NaCl, 2mm TCEP和10%甘油(v/v)组成。缓冲DgydF4y2BaB-RSgydF4y2Ba含有50mm Tris-base (pH值7.5),2mm TCEP和10%甘油(v/v)。缓冲EgydF4y2BaB-RSgydF4y2Ba由50mm Tris-base (pH 7.5), 1m NaCl, 2mm TCEP和10%甘油(v/v)组成。gydF4y2Ba
KaiC的系统发育树gydF4y2Ba
本研究中使用的蛋白质序列经多步鉴定。在第一步中,使用BLASTP算法识别序列的选择,利用基于KaiC的蛋白质序列的查询gydF4y2Ba年代。gydF4y2BaelongatusgydF4y2Ba(基因库:gydF4y2BaWP_011242648.1gydF4y2Ba)gydF4y2Ba38gydF4y2Ba.查询在NCBI的非冗余蛋白数据库中运行,排除模型或未培养和环境样本序列。使用MAFFT对所选1538个序列进行多序列比对gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba(补充数据集gydF4y2Ba1gydF4y2Ba).使用RAxML (v.8.2.9)生成KaiC的初始系统发育树时,将这种比对作为输入。gydF4y2Ba42gydF4y2Ba使用PROTGAMMALG模型。然后使用生成的树来识别KaiB的出现,以创建最终的树,该树专注于包含KaiBC或KaiABC的系统。为此,对来自的KaiB序列的每个分支尖端执行BLASTP搜索gydF4y2Ba年代。gydF4y2BaelongatusgydF4y2Ba,结果仅限于分枝尖端被鉴定的生物体。KaiB出现的分支点与先前的结果很好地吻合,表明KaiB主要出现在非古菌、非变形菌中gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
为了确保最好的序列覆盖率,使用KaiB作为查询的BLASTP搜索(GenBank:gydF4y2BaWP_011242647.1gydF4y2Ba)进行。然后用得到的序列来识别它们来自的生物,这使我们能够创建一个具有已识别的KaiB序列的生物列表。然后,该列表用于选择后续使用KaiC作为查询的BLASTP搜索,从而仅识别同时包含KaiB和KaiC的生物的KaiC序列。进行了抽查以确认,例如,KaiA确实在除gydF4y2Ba原绿球藻gydF4y2Ba.使用CD-HIT对所获得的序列进行裁剪,只包括序列同源性为90%或更低的序列gydF4y2Ba43gydF4y2Ba总共得到401个序列。对于系统发育树的计算,RecA从gydF4y2Ba年代。gydF4y2Ba拉长了gydF4y2Ba被添加为外组。序列用MAFFT比对gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba(补充数据集gydF4y2Ba2gydF4y2Ba)与E-INS-I算法gydF4y2Ba44gydF4y2Ba.然后使用lg替换矩阵,将多序列比对作为输入,使用IQ-TREE (v.1.6.beta5)计算系统发育树gydF4y2Ba45gydF4y2Ba使用freeRate模型(使用10个类别;LG + R10)gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba.要确定分支支持,需要进行aBayes测试gydF4y2Ba48gydF4y2BaSH-aLRT测试(20,000次自举重复gydF4y2Ba49gydF4y2Ba)和超快自举(20,000次自举重复)gydF4y2Ba50gydF4y2Ba)(补充数据集gydF4y2Ba1gydF4y2Ba;分支支持顺序:SH-aLRT支持(%)/aBayes支持/超快引导支持(%))。gydF4y2Ba
x射线晶体学gydF4y2Ba
KaiCgydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaRSgydF4y2Ba-Δcoil晶体使用96孔Intelli-Plate (102-0001-00, Art Robbins)在291 K通过静滴蒸汽扩散获得。滴液中含0.5 μl结晶液,0.5 μl蛋白10 mg mlgydF4y2Ba1gydF4y2Ba20 mM MOPS pH 6.5, 50 mM NaCl, 2 mM TCEP, 5 mM MgClgydF4y2Ba2gydF4y2Ba, 3 mM ATP和1 mM AMPPCP,并与50 μl溶液在储层中进行平衡。的KaiCgydF4y2BaRSgydF4y2Ba结晶溶液由200 mM六水氯化镁,100 mM HEPES pH 7.5和30% (w/v) PEG 400组成。KaiCgydF4y2BaRSgydF4y2Ba-Δcoil晶体使用200 mM醋酸铵,100 mM柠檬酸钠三基二水pH 5.6和30% (w/v) PEG 4000生长。gydF4y2Ba
KaiC中的peg400gydF4y2BaRSgydF4y2Ba结晶液为低温保护剂,KaiC为低温保护剂gydF4y2BaRSgydF4y2Ba-Δcoil晶体被低温保护在LV低温油(MiTeGen)。单晶在液氮中冷却,在100 K的ALS光束线8.2.1处采集x射线衍射图像(数据收集详见扩展数据表)gydF4y2Ba1gydF4y2Ba).数据被索引并集成到iMosflm中gydF4y2Ba51gydF4y2Ba,并在Aimless进行了扩展和合并gydF4y2Ba52gydF4y2Ba.gydF4y2Ba
得到KaiC的结构模型gydF4y2BaRSgydF4y2Ba首先是KaiCgydF4y2BaRSgydF4y2Ba在MRage中通过分子置换解决-Δcoil结构gydF4y2Ba53gydF4y2Ba使用KaiCgydF4y2BaRSgydF4y2Ba序列(残基1-490)作为输入,在PDB数据库中搜索同源词。最初的KaiCgydF4y2BaRSgydF4y2Ba基于KaiC的-Δcoil结构gydF4y2BaSEgydF4y2Ba(PDB:gydF4y2Ba1 tf7gydF4y2Ba(ref。gydF4y2Ba36gydF4y2Ba))是手动重建在Coot (v.0.9.81)gydF4y2Ba54gydF4y2Ba并在Phenix中进行了改进(v.1.20.1-4487)gydF4y2Ba55gydF4y2Ba.最后是KaiCgydF4y2BaRSgydF4y2Ba在Phaser中使用-Δcoil结构作为分子替换搜索模型gydF4y2Ba56gydF4y2Ba来求解全长KaiCgydF4y2BaRSgydF4y2Ba结构。gydF4y2Ba
分配的空间组在Zanuda中得到验证gydF4y2Ba57gydF4y2Ba,并用Achesym对非对称单元在单位细胞中的位置进行标准化gydF4y2Ba58gydF4y2Ba.KaiCgydF4y2BaRSgydF4y2Ba使用SamCC-Turbo (v.0.0.2)分析线圈寄存器,默认套接字截止值为7.4。gydF4y2Ba59gydF4y2Ba).蛋白质结构图像使用PyMOL (v.2.6.0)进行渲染gydF4y2Ba60gydF4y2Ba.gydF4y2Ba
隧道检测计算采用CAVER 3.0.2 PyMOL插件进行gydF4y2Ba61gydF4y2Ba,最小探测半径在0.9 ~ 1.1之间变化。所有其他参数都使用默认值。除了水,所有的原子都被用于计算。起点残基选择为Glu62、Glu63和ADP602。水在CI域中的催化位置由过渡态模拟束缚F的晶体结构模拟gydF4y2Ba1gydF4y2Ba腺苷三磷酸酶(PDB:gydF4y2Ba1 w0jgydF4y2BaD链中的2064水gydF4y2Ba62gydF4y2Ba).gydF4y2Ba
低温电子显微镜和图像处理gydF4y2Ba
用于制备EM网格,3-4 μl为4.3 mg mlgydF4y2Ba1gydF4y2Ba(每单体浓度)样品在20 mM MOPS pH 6.50, 50 mM NaCl, 2 mM TCEP, 10 mM MgClgydF4y2Ba2gydF4y2Ba2 mM ATP应用于发光放电1.2/1.3 400目c平碳涂层铜网格(Protochips)。网格使用Vitrobot Mark IV (ThermoFisher)在4°C和95%湿度下冷冻,印迹时间为4秒。所有数据集都是在一个加速电压为300 keV的Titan Krios上收集的,有一个GIF量子能量滤波器(Gatan)和一个由SerialEM控制的Gatan K2 Summit直接电子探测器gydF4y2Ba63gydF4y2Ba.gydF4y2Ba
对原始冷冻em图像的检查显示,十二聚体粒子的单个六聚体之间的相对取向存在一些异质性,可能是由于线圈区域的固有灵活性,这将分辨率限制在3.3-3.4 Å。为了获得更高分辨率的重建,十二聚体被拆分并作为单独的六聚体处理,使用gydF4y2BaCgydF4y2Ba6对称应用于整个处理过程。为了重建完整的十二聚体重构,使用Chimera中的“fit in map”功能,将六聚体重构的两个副本相互叠加gydF4y2Ba64gydF4y2Ba使一个六聚体与另一个六聚体的低分辨率端密度相匹配。然后将重叠的六聚体组合在一起,创建一个新的映射,其中每个体素从具有最高绝对值的六聚体中获取值。gydF4y2Ba
对于KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E单独收集了大约2500部电影的数据集。这些电影的像素大小为1.074 Å,包括70帧,曝光率为1.31 egydF4y2Ba−gydF4y2Ba每一个gydF4y2Ba2gydF4y2Ba每帧。大约825,000个粒子被挑选出来,在二维分类后,大约320,000个来自良好等级平均的粒子被继续进行进一步处理。重建的最终测量分辨率为2.9 Å(扩展数据图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
对于KaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E: KaiBgydF4y2BaRSgydF4y2Ba复杂,收集了大约2000部电影的数据集。这些电影的像素大小为1.023 Å,包括70帧,曝光率为1.35 egydF4y2Ba−gydF4y2Ba每一个gydF4y2Ba2gydF4y2Ba每帧。大约44万个粒子被挑选出来,在二维分类之后,大约19万个来自良好等级平均的粒子被继续进行进一步处理。重建的最终测量分辨率为2.7 Å(扩展数据图。gydF4y2Ba4 bgydF4y2Ba).gydF4y2Ba
所有数据处理均使用gydF4y2Ba独联体gydF4y2BaTEM (v.2.0.0)gydF4y2Ba65gydF4y2Ba,并遵循了运动校正、CTF参数估计、粒子选取、二维分类、从头算三维地图生成、三维细化、三维分类、每个粒子CTF细化和b因子锐化的工作流程。对于两次重建,使用的最高3D细化分辨率为4 Å,最终分辨率使用gydF4y2Ba独联体gydF4y2BaTEM PartFSC的阈值为0.143。gydF4y2Ba
为了验证组合的十二聚体结构,我们还将两个数据集处理为完整的gydF4y2BaDgydF4y2Ba6个对称十二聚体(扩展数据图。gydF4y2Ba4摄氏度gydF4y2Ba,gydF4y2BadgydF4y2Ba).这是通过将拾取的六聚体提取到一个大盒子大小,并执行带有自动居中的2D分类来实现的。然后从原始图像中选择并重新提取清晰的十二聚体类平均值,并通过所需的平移调整坐标以匹配居中类平均值。在此居中之后,重复的选择被移除,以获得最终的十二聚体粒子堆栈。这些堆栈的处理如上所述,3D细化的最高分辨率为4.25 Å。gydF4y2Ba
试图找到偏离gydF4y2BaDgydF4y2Ba6对称性,我们也计算重建的两种结构假设gydF4y2BaCgydF4y2Ba1对称性,从从头算3D步骤开始。由此产生的细化gydF4y2BaCgydF4y2Ba1结构未表现出可检测到的偏离D6对称性(扩展数据图。gydF4y2Ba4 egydF4y2Ba).因此,我们将对称的体积作为我们的最终结果。gydF4y2Ba
使用KaiC构建了低温电镜结构gydF4y2BaRSgydF4y2Ba通过x射线晶体学和折叠开关稳定的KaiB得到的模型gydF4y2BaTEgydF4y2Ba(PDB:gydF4y2Ba5 jwogydF4y2Ba(ref。gydF4y2Ba26gydF4y2Ba)作为起点。模型是使用Coot (v.0.9.81)构建的。gydF4y2Ba54gydF4y2Ba,并使用Phenix (v.1.20.1-4487)进行细化gydF4y2Ba55gydF4y2Ba.gydF4y2Ba
未磷酸化KaiC的制备gydF4y2BaRSgydF4y2Ba
纯化KaiCgydF4y2BaRSgydF4y2Ba(约20 μM)在- 80℃条件下,在20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP, 10 mM MgCl中透析gydF4y2Ba2gydF4y2Ba和0.1 mM ADP过夜,在4°C去除甘油,用ADP代替ATP。透析后的KaiCgydF4y2BaRSgydF4y2Ba然后在30°C加热4小时,得到完全未磷酸化的KaiCgydF4y2BaRSgydF4y2Ba与ADP结合,样品通过0.22 μm Spin-X离心管过滤器(康宁)。样品在4℃下被浓缩到更高的浓度(小于100 μM)。蛋白浓度用BCA法测定。gydF4y2Ba
体外KaiBCgydF4y2BaRSgydF4y2Ba反应gydF4y2Ba
KaiC动力学gydF4y2BaRSgydF4y2BaKaiB存在和不存在时的自磷酸化gydF4y2BaRSgydF4y2Ba
磷酸化KaiCgydF4y2BaRSgydF4y2Ba(3.5 μM,如上所述制备)gydF4y2BaRSgydF4y2Ba(3.5 μM和35 μM)在20mm MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgCl中预培养1 hgydF4y2Ba2gydF4y2Ba和0.1毫米ADP。反应开始时,加入3.9 mM ATP,以获得最终浓度为4 mM的核苷酸,存在2 U mlgydF4y2Ba1gydF4y2Ba丙酮酸激酶(Millipore Sigma)和10 mM磷酸烯醇丙酮酸(Millipore Sigma)在反应过程中再生ATP。反应样品在特定时间点手工采样,并与等量负载染料(原液浓度0.1 M Tris-base (pH 7.5), 4% SDS, 0.2%溴酚蓝,30%甘油和0.5 M 2-巯基乙醇)混合。然后将混合样品存储在−20°C,直到进一步使用。gydF4y2Ba
KaiC动力学gydF4y2BaRSgydF4y2BaKaiB存在和不存在时的自去磷酸化gydF4y2BaRSgydF4y2Ba
纯化KaiCgydF4y2BaRSgydF4y2Ba(20 μM左右)在含有20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgCl的反应缓冲液中透析gydF4y2Ba2gydF4y2Ba和0.1 mM ADP在4°C过夜以去除甘油并生成KaiCgydF4y2BaRSgydF4y2Ba与ADP结合。4°C透析后,KaiCgydF4y2BaRSgydF4y2Ba存在于两种状态:50%未磷酸化和50%单磷酸化Ser413 (pSer413),这是由串联质谱证实的(数据未显示)。加入KaiC启动自脱磷酸化反应gydF4y2BaRSgydF4y2Ba或KaiCgydF4y2BaRSgydF4y2BaKaiB在场gydF4y2BaRSgydF4y2Ba(3.5 μM)进入30°C预平衡的反应缓冲液。gydF4y2Ba
KaiBC振荡gydF4y2BaRSgydF4y2Ba
透析KaiCgydF4y2BaRSgydF4y2Ba(3.5 μM)在20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgCl中,35°C预培养30 mingydF4y2Ba2gydF4y2Ba和0.1 mM ADP的存在或不存在KaiBgydF4y2BaRSgydF4y2Ba(3.5μM)。加入4 mM ATP开始反应,在特定时间点收集反应样品进行10% SDS-PAGE和HPLC分析,以确定KaiC的磷酸化状态gydF4y2BaRSgydF4y2Ba和每个时间点的核苷酸数量。gydF4y2Ba
控制atp - adp比值,模拟白天和夜晚的时间gydF4y2Ba
KaiCgydF4y2BaRSgydF4y2Ba在含有20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgClgydF4y2Ba2gydF4y2Ba和1mm ATP在4°C过夜。启动如图所示的反应。gydF4y2Ba3 cgydF4y2Ba, KaiCgydF4y2BaRSgydF4y2Ba(3.5 μM)gydF4y2BaRSgydF4y2Ba(3.5 μM)与额外的ATP(最后4 mM以模拟白天)混合,将反应样品(500 μl)添加到d管透析仪(midi 3.5 kDa cut, EMD Millipore)中,与4 mM ATP缓冲液(400 ml)交换。在12小时时间点后,将反应样品转移到预培养的25% ATP/ADP缓冲液(400 ml)中,模拟夜间时间。24 h时间点后,同样的样品换入预孵育的4 mM ATP,再次模拟白天。gydF4y2Ba
开始实验,如图扩展数据图所示。gydF4y2Ba6gydF4y2Ba, KaiCgydF4y2BaRSgydF4y2Ba(35 μM)在3mm ATP存在的20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP和10 mM MgClgydF4y2Ba2gydF4y2Ba在35°C加热25分钟以产生完全磷酸化的KaiCgydF4y2BaRSgydF4y2Ba.的KaiCgydF4y2BaRSgydF4y2Ba然后将样品稀释10倍到30°C预平衡的25% ATP/ADP缓冲液中,直至KaiC的最终浓度gydF4y2BaRSgydF4y2Ba(3.5 μM)和KaiBgydF4y2BaRSgydF4y2Ba(3.5 μM或35 μM)。反应样品(300 μl)加入d管透析仪(midi 3.5 kDa cut, EMD Millipore)中,与25% ATP/ADP缓冲液(300 ml)交换。gydF4y2Ba
反应过程中,在30°C培养箱中轻摇样品,在特定时间点收集反应样品进行10% SDS-PAGE和HPLC分析,以确定KaiC的磷酸化状态gydF4y2BaRSgydF4y2Ba以及每个时间点的核苷酸数量。gydF4y2Ba
日间和夜间atp - adp比值的理论依据来自于两个早期的文献报告。在该菌株体内直接测定日间和夜间atp - adp比值的变化gydF4y2BaR。gydF4y2BasphaeroidesgydF4y2Ba27gydF4y2Ba,其中ATP白天为2.0-2.4 mM,夜间下降到0.5-0.6 mM,总核苷酸浓度保持恒定,这是众所周知的。我们在体外实验中选择了4 mM的总核苷酸浓度,以与典型KaiC的体外实验相同gydF4y2BaSEgydF4y2Ba.由于在日光下进行光合作用,几乎所有的核苷酸都是ATPgydF4y2Ba33gydF4y2Ba.我们注意到稍微高一点的ATP量不会影响我们的结果,因为KaiC的亲和力gydF4y2BaRSgydF4y2BaATP的含量高于ADP。gydF4y2Ba
分离未磷酸化、单磷酸化和双磷酸化的KaiCgydF4y2BaRSgydF4y2Ba通过sds - pagegydF4y2Ba
未磷酸化、单磷酸化和双磷酸化KaiCgydF4y2BaRSgydF4y2Ba以35:1丙烯酰胺:双丙烯酰胺(Bio-Rad), 18 cm × 16 cm × 1 mm Tris-HCl凝胶,1× tris -甘氨酸SDS运行缓冲液(Invitrogen), 10% SDS - page分离。样品在95°C下加热3分钟,400 ng材料加载到Tris-HCl凝胶上。使用Hoefer SE600电泳仪,在冷室中用35 mA, 150 W的恒流,700v以上的电压运行凝胶5.5小时,水浴温度设置为12°C。gydF4y2Ba
未磷酸化和磷酸化KaiCgydF4y2BaRSgydF4y2Ba-Δcoil由ZngydF4y2Ba2 +gydF4y2Ba含有50 μM Phos-tag丙烯酰胺(Wako)的10%丙烯酰胺凝胶的Phos-tag SDS-PAGE。凝胶在30 mA恒电流下在冷室中运行5 h 30 min,每孔1 μg蛋白样品在95°C下预热3 min。gydF4y2Ba
凝胶在室温下用InstantBlue蛋白凝胶染色剂(Expedeon)染色过夜,轻轻摇动,用蒸馏水染色,直到清晰可见条带。凝胶在ChemiDoc成像仪(Bio-Rad)上成像,并使用Image Lab软件(Bio-Rad)进行分析。gydF4y2Ba
凝胶电泳的统计和重现性gydF4y2Ba
正文图和扩展数据图中显示的数据是至少三个独立生物重复的代表性SDS-PAGE凝胶(gydF4y2BangydF4y2Ba= 3),除图中实验外。gydF4y2Ba3 a, cgydF4y2Ba,一式两份。gydF4y2Ba
KaiC的寡聚态gydF4y2BaRSgydF4y2Ba和KaiBgydF4y2BaRSgydF4y2Ba
凝胶过滤色谱法gydF4y2Ba
KaiCgydF4y2BaRSgydF4y2Ba,未磷酸化KaiCgydF4y2BaRSgydF4y2Ba和所有的KaiCgydF4y2BaRSgydF4y2Ba以0.2 ml min加载浓度为40 ~ 80 μM的突变体gydF4y2Ba1gydF4y2Ba到预包装Superdex-200 10/300 GL (GE Healthcare)上,预平衡20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP, 10 mM MgClgydF4y2Ba2gydF4y2Ba和1 mM ATP (0.1 mM ADP为未磷酸化的KaiCgydF4y2BaRSgydF4y2Ba)在4°C下使用ÄKTA Pure系统(GE Healthcare)。KaiBgydF4y2BaRSgydF4y2Ba(0.5 mM)加载到Superdex-75 10/300 GL (GE Healthcare)上,在4°C下与20 mM MOPS (pH 6.5)、50 mM NaCl和2 mM TCEP预平衡。以每1ml的馏分收集洗脱液并进行SDS-PAGE分析。使用分子量蛋白标准品(Bio-Rad)在相同的缓冲液和流速下运行,确定色谱柱的标准曲线(即分子量与洗脱时间的关系)。蛋白质标准混合物含有甲状腺球蛋白(670 kDa), γ-球蛋白(158 kDa),卵白蛋白(44 kDa),肌红蛋白(17 kDa)和维生素BgydF4y2Ba12gydF4y2Ba(1.35 kDa)。gydF4y2Ba
分析超速离心法gydF4y2Ba
沉降速度离心实验在50,000转/分进行。(KaiBgydF4y2BaRSgydF4y2Ba)和30,000 r.p.m(为KaiCgydF4y2BaRSgydF4y2Ba野生型和突变体以及KaiCgydF4y2BaSEgydF4y2Ba),在贝克曼Optima XL-A (Beckman- coulter)上,在20°C下,以0.005厘米的间隔连续扫描5.8至7.3厘米,配备吸收光学系统和四孔An60Ti转子。测量设置在280 nm (KaiBgydF4y2BaRSgydF4y2Ba)和295 nm(用于KaiCgydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaSEgydF4y2Ba)以避免ATP的干扰。数据评价采用软件包SEDFIT (v.14.1)gydF4y2Ba66gydF4y2BagydF4y2Ba.KaiCgydF4y2BaRSgydF4y2Ba和KaiCgydF4y2BaRSgydF4y2Ba-Δcoil (100 μM)用20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgCl制备gydF4y2Ba2gydF4y2Ba和1mm ATP。KaiCgydF4y2BaSEgydF4y2Ba在20 mM MOPS (pH 8.0)、150 mM NaCl、2 mM TCEP、5 mM MgCl中制备(100 μM)gydF4y2Ba2gydF4y2Ba,和1mm ATP。KaiBgydF4y2BaRSgydF4y2Ba在20 mM MOPS (pH 6.5)、50 mM NaCl和2 mM TCEP中制备(500 μM)。gydF4y2Ba
腺苷三磷酸酶活性gydF4y2Ba
纯化KaiCgydF4y2BaRSgydF4y2Ba(野生型和突变型(约20 μM))和KaiBgydF4y2BaRSgydF4y2Ba(约90 μM)在20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgCl中透析gydF4y2Ba2gydF4y2Ba和1mm ATP(反应缓冲液)在4°C过夜。样品通过0.22 μm Spin-X离心管过滤器,在反应前用BCA法测定浓度。典型KaiCgydF4y2BaRSgydF4y2Ba或KaiBCgydF4y2BaRSgydF4y2Ba反应中含有3.5 μM KaiCgydF4y2BaRSgydF4y2Ba(野生型和突变体)和3.5 μM KaiBgydF4y2BaRSgydF4y2Ba在反应缓冲液中,最终浓度为4 mM ATP。样品在指定的温度下孵育,并在特定的时间点手工采样。取10 μl样品,用10 μl 10%三氯乙酸(Millipore Sigma)淬灭,混合物经0.22 μm Spin-X离心管过滤器去除沉淀蛋白。然后通过添加10 μl 0.75 M HEPES (pH 8.0)重新调整样品的流量至pH 6.2进行核苷酸分离。最终样品保存在−20°C,直到HPLC分析。gydF4y2Ba
用高精度自动进样器(进样误差<0.1 μl,导致最大系统误差约6%)将各3微升样品注入反相高效液相色谱仪,该仪器具有ACE粒径为5 μm, C18-AR和100 Å孔径柱(Advanced Chromatography Technologies)。仪器预平衡100mm磷酸钾pH 6.2,流速0.4 ml mingydF4y2Ba1gydF4y2Ba.用纯核苷酸样品测定ATP、ADP和AMP的保留时间分别为2.6、3.1和4.4 min。各核苷酸的浓度由峰面积与总核苷酸浓度的相对比值计算。为了确定atp酶活性速率,使用初始速率分析和最小二乘线性回归从每个温度的至少五个数据点确定观测到的速率常数(扩展数据图。gydF4y2Ba6 c, dgydF4y2Ba而且gydF4y2Ba8罪犯gydF4y2Ba).其平均值和不确定性(s.d.)如图所示。gydF4y2Ba3 dgydF4y2Ba,扩展数据图。gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba8gydF4y2Ba由三次重复实验得出。KaleidaGraph (v.4.5.3;Synergy)用于数据分析和绘图。gydF4y2Ba
核苷酸交换gydF4y2Ba
KaiCgydF4y2BaRSgydF4y2Ba(野生型或突变体)和KaiBgydF4y2BaRSgydF4y2Ba透析成20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgClgydF4y2Ba2gydF4y2Ba50 μM ATP放置4℃。样品通过0.22 μm Spin-X离心管过滤器,采用BCA法测定蛋白浓度。反应中KaiC的含量为3.5 μMgydF4y2BaRSgydF4y2Ba-S413E和/或35 μM的KaiBgydF4y2BaRSgydF4y2Ba,样品在20、25、30和35℃下在atp回收系统中孵育16-24小时。通过添加250 μM的mant-ATP (Jena Bioscience)开始反应。利用KaiC中色氨酸残基的荧光能量转移来测量光谱gydF4y2BaRSgydF4y2Ba通过在290 nm (2.5 nm带宽)激发样品并收集从320 nm到550 nm (5 nm带宽)2 nm增量的发射强度,将样品转化为mant-ATP。为了测量核苷酸交换率,荧光强度在440 nm处的最大变化(ΔgydF4y2BaFgydF4y2Ba440海里gydF4y2Ba),在FluoroMax-4荧光光谱仪(Horiba Scientific)上使用抗光漂白模式,以15秒为增量跟踪1800秒的总时间,并配备水浴以控制温度。在KaiCII的核苷酸结合位点5 Å内有两个色氨酸残基gydF4y2BaRSgydF4y2Ba在KaiCI的核苷酸结合位点附近没有色氨酸残留gydF4y2BaRSgydF4y2Ba因此,实验中观察到的核苷酸交换是针对KaiCII的gydF4y2BaRSgydF4y2Ba域。确保实验中观察到的交换速率均来自于核苷酸交换中的KaiCIIgydF4y2BaRSgydF4y2Ba域,KaiCIgydF4y2BaRSgydF4y2Ba(仅包含CI域)进行了测试;添加mant-ATP后荧光没有变化(扩展数据图)。gydF4y2Ba8 hgydF4y2Ba).gydF4y2Ba
KaiC的实验gydF4y2BaSEgydF4y2Ba单独和KaiCgydF4y2BaSEgydF4y2Ba和KaiA混在一起gydF4y2BaSEgydF4y2Ba以类似的方式进行,除了KaiCgydF4y2BaSEgydF4y2Ba和KaiAgydF4y2BaSEgydF4y2Ba在20mm MOPS (ph8.0), 150mm NaCl, 2mM TCEP, 10mm MgClgydF4y2Ba2gydF4y2Ba50 μM ATP放置4℃。KaiAgydF4y2BaSEgydF4y2Ba与KaiC一起孵化gydF4y2BaSEgydF4y2Ba加入250 μM mant-ATP后,在30℃下静置1 h。gydF4y2Ba
核苷酸偏好实验,KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E和KaiCgydF4y2BaRSgydF4y2Ba-S413A/S414A在20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP, 10 mM MgCl中透析gydF4y2Ba2gydF4y2Ba20 μM ADP在4℃下过夜。KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E或KaiCgydF4y2BaRSgydF4y2Ba首先将-S413A/S414A (3.5 μM)与mant-ATPγS或mant-ADP (150 μM)混合,在30℃下,在440 nm处记录动力学迹。在440 nm处的荧光迹迹达到一个平台后,这表明核苷酸类似物完全与蛋白质结合,加入27倍过量的ATP (4 mM)来取代结合的核苷酸类似物,并在30°C下记录440 nm处荧光强度的衰减。实验进行了三次,结果被平均,并适合于一个单一的指数衰减。gydF4y2Ba
通过使用KinTek Explorer软件将单个痕迹拟合到指数方程中进行分析gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba)gydF4y2Ba,误差柱为三次重复实验所得的标准误差。KaleidaGraph (v.4.5.3;Synergy)用于数据绘图。gydF4y2Ba
32gydF4y2BaP-ATP放射性标记及实验gydF4y2Ba
32gydF4y2BaP-labelled KaiCgydF4y2BaRSgydF4y2Ba通过混合未磷酸化的KaiCgydF4y2BaRSgydF4y2Ba0.46 μM [γ-gydF4y2Ba32gydF4y2BaP]ATP (3000 Ci mmolgydF4y2Ba1gydF4y2Ba, PerkinElmer)和500 μM ATP在20mm MOPS (pH 6.5), 50mm NaCl, 2mm TCEP和10mm MgCl中gydF4y2Ba2gydF4y2Ba在35°C下30分钟,然后立即切换到4°C,以防止KaiC的去磷酸化gydF4y2BaRSgydF4y2Ba.的gydF4y2Ba32gydF4y2BaP-labelled KaiCgydF4y2BaRSgydF4y2Ba样品通过Zeba自旋脱盐柱(赛默飞世尔科学公司),预平衡20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP和10 mM MgClgydF4y2Ba2gydF4y2Ba2次,4°C。样品与含有1mm ADP的缓冲液在4℃孵育过夜,得到gydF4y2Ba32gydF4y2BaP-labelled KaiCgydF4y2BaRSgydF4y2Ba与ADP结合。样品通过最终的Zeba脱盐柱,预平衡20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP和10 mM MgClgydF4y2Ba2gydF4y2Ba然后在KaiB存在或不存在的情况下,将溶液与8mm ADP孵育gydF4y2BaRSgydF4y2Ba4°C 1小时。然后用20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP和10 mM MgCl稀释样品gydF4y2Ba2gydF4y2Ba在30°C预孵育,以获得的最终浓度gydF4y2Ba32gydF4y2BaP-labelled KaiCgydF4y2BaRSgydF4y2Ba(5 μM), KaiBgydF4y2BaRSgydF4y2Ba(20 μM)和ADP (4 mM)。反应在30℃下孵育,在不同时间点取等分(1.5 μl)。加入1.5 μl Laemmli样品缓冲液(62.5 mM Tris (pH 6.8), 2% SDS, 25%甘油,0.01%溴酚蓝)和5% (v/v) 2-巯基乙醇,停止反应。gydF4y2Ba
样品放在薄层色谱板(pei -纤维素F板,Merck)上,用吹风机快速干燥30秒。TLC板首先以蒸馏水作为流动相运行。TLC板完全干燥后,0.75 M KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4 gydF4y2Ba是否用作流动相分离gydF4y2Ba32gydF4y2BaP-labelled KaiCgydF4y2BaRSgydF4y2Ba,(γ-gydF4y2Ba32gydF4y2BaP]ATP和无机磷酸盐(gydF4y2Ba32gydF4y2BaP),如前所述gydF4y2Ba29gydF4y2Ba.磷屏在Amersham Typhoon (GE Healthcare)上以100 μm的分辨率进行扫描。采用ImageQuant TL 7.0软件进行分析。gydF4y2Ba
荧光各向异性竞争gydF4y2Ba
荧光各向异性竞争实验在30°C下使用FluoroMax-4荧光光谱仪(Horiba Scientific)进行。KaiB的激发波长和发射波长gydF4y2BaRSgydF4y2Ba用6-碘乙酰氨基荧光素(6-IAF,赛默飞世尔科学公司)标记的Cys29分别设置在492 nm (5 nm带宽)和520 nm (5 nm带宽),G因子(KaiB的G因子)固定gydF4y2BaRS -gydF4y2Ba仅iaf)来消除仪器偏差。计算了10次重复测量的平均各向异性和标准误差。gydF4y2Ba
KaiBgydF4y2BaRSgydF4y2Ba将脱气后的KaiB混合制备-6IAFgydF4y2BaRSgydF4y2Ba(100 μM),在20mm Tris-base (ph7.0), 50mm NaCl和1mm TCEP(脱气)中加入20倍的6-IAF (50% DMSO中10 mM原液)。反应在室温下孵育4小时,然后在3.5 kDa透析盒中与20 mM Tris-base (pH 7.0)、50 mM NaCl和1 mM TCEP在4℃下透析过夜,以去除未反应的6-IAF和少量DMSO。交联样品通过0.22 μm的自旋- x离心管过滤器,加载到Superdex-75 10/300 GL上,预平衡20 mM MOPS (pH 7.0), 50 mM NaCl和1 mM TCEP, 0.2 ml mingydF4y2Ba1gydF4y2Ba去除剩余未反应6-IAF的流速。样品在液氮中闪冻并在−80°C保存直到使用。所有交联反应都是在黑暗中进行的。gydF4y2Ba
对于荧光各向异性竞争结合实验,KaiBgydF4y2BaRSgydF4y2Ba-6IAF (0.2 ~ 0.4 μM)首先与野生型或突变型KaiC孵育gydF4y2BaRSgydF4y2Ba(1 μM,各向异性比KaiB提高60%gydF4y2BaRSgydF4y2Ba-6IAF单独)20 mM MOPS (pH 6.5), 50 mM NaCl, 2 mM TCEP和10 mM MgClgydF4y2Ba2gydF4y2Ba在存在4mm ADP或4mm ATP的ATP回收系统(2u mlgydF4y2Ba1gydF4y2Ba丙酮酸激酶和10 mM磷酸烯醇丙酮酸),然后是未标记的KaiBgydF4y2BaRSgydF4y2Ba样品中加入(0 ~ 50 μM)。样品在30°C下孵育4小时或12小时后测量。gydF4y2Ba
荧光各向异性(FA)随未标记KaiB浓度的降低gydF4y2BaRSgydF4y2Ba拟合方程(gydF4y2Ba1gydF4y2Ba)利用KaleidaGraph (Synergy Software)中包含的Levenberg-Marquardt非线性拟合算法,得到半最大抑菌浓度(ICgydF4y2Ba50gydF4y2Ba)值。的gydF4y2BaKgydF4y2BadgydF4y2Ba值即可从集成电路中计算gydF4y2Ba50gydF4y2Ba计算公式(gydF4y2Ba2gydF4y2Ba),如上文所述gydF4y2Ba69gydF4y2Ba。gydF4y2Ba
下拉化验gydF4y2Ba
下拉实验探讨了KaiC之间的相互作用gydF4y2BaRSgydF4y2Ba(野生型和突变体)gydF4y2BaRSgydF4y2Ba(他gydF4y2Ba6gydF4y2Ba-MBP-TEV-KaiBgydF4y2BaRSgydF4y2Ba).他的gydF4y2Ba6gydF4y2Ba-MBP-TEV-KaiBgydF4y2BaRSgydF4y2Ba按照上述方法进行表达和纯化,但不进行TEV蛋白酶裂解步骤。野生型或突变型KaiCgydF4y2BaRSgydF4y2Ba(3.5 μM)与KaiB混合gydF4y2BaRSgydF4y2Ba-标签(3.5 μM)在20mm MOPS (pH 6.5), 50mm NaCl, 2mm TCEP和10mm MgCl中gydF4y2Ba2gydF4y2Ba以4mm ADP或4mm ATP存在,ATP再循环系统,最终体积为400 μl。样品在25℃下孵育4小时或24小时,然后加载到500 μl的旋转柱上,加入200 μl(从400 μl 50%浆液中制备)与样品缓冲液预平衡的Talon珠(Takara)。样品与Talon珠一起孵育30分钟,轻轻摇晃,之后通过重力收集到1ml Eppendorf管中。用400 μl样品缓冲液重力洗涤3次,然后用200 μl 0.5 M咪唑缓冲液1000离心洗脱gydF4y2BaggydF4y2Ba1分钟。蛋白质混合物、流经、洗涤和洗脱样品在带有分子量标记的Bis-Tris 4-12%梯度SDS-PAGE凝胶上运行。凝胶用考马斯蓝染色,并在ChemiDoc成像仪(Bio-Rad)上成像。图像实验室软件(Bio-Rad)进行分析。gydF4y2Ba
对照实验:(1)融合KaiBgydF4y2BaRSgydF4y2Ba蛋白在缺乏KaiCgydF4y2BaRSgydF4y2Ba;(2) KaiCgydF4y2BaRSgydF4y2Ba在没有融合KaiB的情况下gydF4y2BaRSgydF4y2Ba.所有的融合KaiBgydF4y2BaRSgydF4y2Ba在第一个对照实验中,只有洗脱缓冲液中出现蛋白,这表明融合KaiBgydF4y2BaRSgydF4y2Ba结合魔爪珠和KaiB的数量gydF4y2BaRSgydF4y2BaUsed没有使列过载。所有KaiCgydF4y2BaRSgydF4y2Ba在第二次对照实验中,蛋白在流动通道中流出,说明KaiC与KaiC之间没有特异性结合gydF4y2BaRSgydF4y2Ba还有魔爪珠子。gydF4y2Ba
Thermofluor化验gydF4y2Ba
KaiCgydF4y2BaRSgydF4y2Ba最终浓度分别为3 μM和10×的SYPRO Orange (Thermo Fisher Scientific)。实验在20 mM MOPS (pH 6.5)、50 mM NaCl、2 mM TCEP、10 mM MgCl中进行gydF4y2Ba2gydF4y2Ba4毫米ADP或ATP。样品在MicroAmp Fast Optical 96孔反应板(Applied Biosystems Life Technologies)中制备至最终体积为20 μl,并用Axygen UltraClear密封膜(Corning)密封。检测板在StepOne Real-Time PCR仪(Applied Biosystems Life Technologies)中运行,并建立熔体曲线。温度从25°C持续升高到95°C,每15 s增加0.3°C。数据在KaleidaGraph (Synergy Software)中进行非线性拟合,拟合为玻尔兹曼s型曲线(方程(gydF4y2Ba3 gydF4y2Ba))。gydF4y2Ba
在哪里gydF4y2BaYgydF4y2Ba温度下的荧光强度是多少gydF4y2BaTgydF4y2Ba,gydF4y2BaTgydF4y2Ba为温度,单位为摄氏度,Bottom为低温下的基线荧光,Top为截断数据顶部的最大荧光,gydF4y2BacgydF4y2Ba曲线的斜率或陡度,和gydF4y2BaTgydF4y2Ba米gydF4y2Ba是蛋白质的熔化温度。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
使用x射线晶体学获得的结构因子和精细模型已根据登录代码存入PDBgydF4y2Ba8 dbagydF4y2Ba(野生型KaiCgydF4y2BaRSgydF4y2Ba),gydF4y2Ba8 db4gydF4y2Ba(KaiCgydF4y2BaRSgydF4y2Ba-∆线圈)。Cryo-EM图谱和精细模型已分别存入电子显微镜数据库(EMDB)和PDB。KaiC的复合地图和模型gydF4y2BaRSgydF4y2Ba-S413E/S414E十二聚体重构在条目下提交gydF4y2Baemd - 29505gydF4y2Ba而且gydF4y2Ba8 fwigydF4y2Ba,分别。KaiCRS-S413E/ S414E-KaiB的复合地图和模型gydF4y2BaRSgydF4y2Ba十二元体重建是在参赛作品下提交的gydF4y2Baemd - 29506gydF4y2Ba而且gydF4y2Ba8 fwjgydF4y2Ba,分别。专注的KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E六聚体改进图可在加入gydF4y2Baemd - 29507gydF4y2Ba以及专注的KaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E-KaiBgydF4y2BaRSgydF4y2Ba六聚体细化图可在加入gydF4y2Baemd - 29508gydF4y2Ba.完整的KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E十二聚体精炼可在加入gydF4y2Baemd - 29509gydF4y2Ba和完整的KaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E-KaiBgydF4y2BaRSgydF4y2Ba十二烷基化合物精炼可在加入时获得gydF4y2Baemd - 29510gydF4y2Ba.所使用的其他数据集都在公共社区或特定于学科的存储库中公开可用(例如,PDB标识符)gydF4y2Ba5 jwqgydF4y2Ba,gydF4y2Ba1 w0jgydF4y2Ba,gydF4y2Ba1 tf7gydF4y2Ba而且gydF4y2Ba7 s65车型gydF4y2Ba).蛋白质序列、序列比对和系统发育的接入代码列在补充数据集中gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
石村,等人。基因簇的表达gydF4y2BakaiABCgydF4y2Ba作为蓝藻细菌的昼夜反馈过程。gydF4y2Ba科学gydF4y2Ba281gydF4y2Ba, 1519-1523(1998)。gydF4y2Ba
Dvornyk, V., Vinogradova, O. & Nevo, E.原核生物生物钟基因的起源和进化。gydF4y2Ba国家科学院学报美国gydF4y2BaOne hundred.gydF4y2Ba, 2495-2500(2003)。gydF4y2Ba
科恩,s.e.和戈尔登,s.s.蓝藻细菌的昼夜节律。gydF4y2BaMicrobiol。摩尔。杂志。牧师。gydF4y2Ba79gydF4y2Ba, 373-385(2015)。gydF4y2Ba
Golden, s.s.蓝藻中出现的节律性原理。gydF4y2Ba欧元。j . >。gydF4y2Ba51gydF4y2Ba, 13-18(2020)。gydF4y2Ba
大分子蛋白质组合对昼夜节律的编排。gydF4y2BaJ. Mol.生物学。gydF4y2Ba432gydF4y2Ba, 3426-3448(2020)。gydF4y2Ba
Rust, M. J., Markson, J. S., Lane, W. S., Fisher, D. S. & O 'Shea, E. K.有序磷酸化控制三蛋白昼夜节律钟的振荡。gydF4y2Ba科学gydF4y2Ba318gydF4y2Ba, 809-812(2007)。gydF4y2Ba
霍尔策多夫,J.等人。基因组流线化导致海洋蓝藻的生物钟失去稳健性gydF4y2Ba原绿球藻gydF4y2BaPCC 9511。gydF4y2Ba生物。节奏gydF4y2Ba23gydF4y2Ba, 187-199(2008)。gydF4y2Ba
Axmann, i.m.等人。计时机制的生化证据gydF4y2BaProchlorococcusgydF4y2Ba.gydF4y2Baj . Bacteriol。gydF4y2Ba191gydF4y2Ba, 5342-5347(2009)。gydF4y2Ba
马P, Mori T.,赵C., Thiel, T. & Johnson, C. H. kaic依赖计时器的进化:原始昼夜节律计时机制赋予紫色细菌的适应性gydF4y2BaRhodopseudomonasgydF4y2BapalustrisgydF4y2Ba.gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba12gydF4y2Ba, e1005922(2016)。gydF4y2Ba
Dvornyk, V. & Knudsen, B.原核生物中生物钟蛋白的功能分歧。gydF4y2Ba遗传gydF4y2Ba124gydF4y2Ba, 247-254(2005)。gydF4y2Ba
郭海燕,熊海燕,闵海燕。紫色光合细菌节律性基因的表达,gydF4y2BaRhodobactergydF4y2BasphaeroidesgydF4y2Ba.gydF4y2Ba2月。gydF4y2Ba579gydF4y2Ba, 808-812(2005)。gydF4y2Ba
卡特,a.p.等人。动力蛋白微管结合域的结构和功能作用。gydF4y2Ba科学gydF4y2Ba322gydF4y2Ba, 1691-1695(2008)。gydF4y2Ba
施梅林,n.m.等人。原核生物生物钟的最小工具集。gydF4y2BaBMC另一个星球。医学杂志。gydF4y2Ba17gydF4y2Ba, 169(2017)。gydF4y2Ba
青木,s, Onai, kgydF4y2Ba细菌昼夜节律程序gydF4y2Ba(编麦基S. R.迪蒂J. L. &约翰逊C. H.) 259-282(施普林格,2009)。gydF4y2Ba
维加德,A.等人。三种假定的KaiC时钟蛋白的生化分析gydF4y2Ba集胞藻属gydF4y2Basp PCC 6803表明它们存在功能分歧。gydF4y2Ba微生物学gydF4y2Ba159gydF4y2Ba, 948-958(2013)。gydF4y2Ba
Pattanayek, R.等人。利用混合结构方法分析蓝藻细菌生物钟中的KaiA-KaiC蛋白相互作用。gydF4y2BaEMBO J。gydF4y2Ba25gydF4y2Ba, 2017-2028(2006)。gydF4y2Ba
Nishiwaki-Ohkawa, T., Kitayama, Y., Ochiai, E. & Kondo, T. CII ATP酶结构域中ADP与ATP的交换促进蓝藻时钟蛋白KaiC的自磷酸化。gydF4y2Ba国家科学院学报美国gydF4y2Ba111gydF4y2Ba, 4455-4460(2014)。gydF4y2Ba
Kim Y. I., Dong, G., Carruthers, C. W. Jr., Golden, S. S. & LiWang, a. KaiC中的昼夜开关,蓝藻生物钟的中心振荡器组件。gydF4y2Ba国家科学院学报美国gydF4y2Ba105gydF4y2Ba, 12825-12830(2008)。gydF4y2Ba
斯旺,J. A.等。在生物钟蛋白KaiC中远端atp酶结构域的偶联。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba29gydF4y2Ba, 759-766(2022)。gydF4y2Ba
Egli, M.等人。环-环相互作用调节kaia刺激的KaiC磷酸化在蓝藻KaiABC生物钟。gydF4y2Ba生物化学gydF4y2Ba52gydF4y2Ba, 1208-1220(2013)。gydF4y2Ba
Hayashi, F.等人。atp诱导蓝藻生物钟蛋白KaiC的六聚体环结构。gydF4y2Ba基因的细胞gydF4y2Ba8gydF4y2Ba, 287-296(2003)。gydF4y2Ba
Nishiwaki, T.等。KaiC磷酸化在小鼠昼夜节律系统中的作用gydF4y2Ba聚球藻属gydF4y2BaelongatusgydF4y2BaPCC 7942。gydF4y2Ba国家科学院学报美国gydF4y2Ba101gydF4y2Ba, 13927-13932(2004)。gydF4y2Ba
徐毅,等。通过晶体学和突变分析鉴定生物钟蛋白KaiC的关键磷酸化位点。gydF4y2Ba国家科学院学报美国gydF4y2Ba101gydF4y2Ba, 13933-13938(2004)。gydF4y2Ba
Kitayama, Y., Iwasaki, H., Nishiwaki, T. & Kondo, T. KaiB在蓝藻生物钟系统中作为KaiC磷酸化的衰减剂。gydF4y2BaEMBO J。gydF4y2Ba22gydF4y2Ba, 2127-2134(2003)。gydF4y2Ba
张,Y. G.等。昼夜节律。在蓝藻中,蛋白质折叠开关将昼夜节律振荡器与时钟输出连接起来。gydF4y2Ba科学gydF4y2Ba349gydF4y2Ba, 324-328(2015)。gydF4y2Ba
Tseng, R.等。细菌昼夜节律中昼夜转换的结构基础。gydF4y2Ba科学gydF4y2Ba355gydF4y2Ba, 1174-1180(2017)。gydF4y2Ba
李国强,李国强,李国强,等。钾离子对质子动力的影响gydF4y2BaRhodobactergydF4y2BasphaeroidesgydF4y2Ba.gydF4y2Baj . Bacteriol。gydF4y2Ba170gydF4y2Ba, 5647-5653(1988)。gydF4y2Ba
Terauchi, K.等。KaiC的atp酶活性决定了蓝藻生物钟的基本时间。gydF4y2Ba国家科学院学报美国gydF4y2Ba104gydF4y2Ba, 16377-16381(2007)。gydF4y2Ba
Nishiwaki, T. & Kondo, T.蓝藻时钟蛋白KaiC的昼夜自去磷酸化通过ATP作为中间体的形成发生。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba, 18030-18035(2012)。gydF4y2Ba
冯,C., Markson, J. S, Wilhoite, C. M. & Rust, M. J.从差异敏感的催化域稳健和可调的昼夜节律。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 1124-1129(2013)。gydF4y2Ba
村上等人。KaiB与KaiC六聚体的协同结合确保了蓝藻中精确的生物钟振荡。gydF4y2BaInt。理学。gydF4y2Ba20.gydF4y2Ba, 4550(2019)。gydF4y2Ba
Snijder, J.等。从KaiB-KaiC相互作用的结构细节深入了解蓝藻的昼夜节律。gydF4y2Ba国家科学院学报美国gydF4y2Ba111gydF4y2Ba, 1379-1384(2014)。gydF4y2Ba
鲁斯特,M. J.,戈尔登,S. S. & O 'Shea, E. K.光驱动的能量代谢变化直接夹带蓝藻昼夜节律振荡器。gydF4y2Ba科学gydF4y2Ba331gydF4y2Ba, 220-223(2011)。gydF4y2Ba
特鲁贝斯坦,L.和伦纳德,T. A.卷线圈:长线圈和短线圈。gydF4y2BaBioessaysgydF4y2Ba38gydF4y2Ba, 903-916(2016)。gydF4y2Ba
刘杰,罗斯特,B.整个蛋白质组的功能和结构比较。gydF4y2Ba蛋白质科学。gydF4y2Ba10克ydF4y2Ba, 1970-1979(2001)。gydF4y2Ba
Pattanayek, R.等人。可视化生物钟蛋白:KaiC的晶体结构和功能见解。gydF4y2Ba摩尔。细胞gydF4y2Ba15gydF4y2Ba, 375-388(2004)。gydF4y2Ba
克里斯奈尔,E. &亨利克,K.从晶体状态推断大分子组装。gydF4y2BaJ. Mol.生物学。gydF4y2Ba372gydF4y2Ba, 774-797(2007)。gydF4y2Ba
阿特舒,S. F.,吉什,W.,米勒,W.,迈尔斯,E. W. &李普曼,D. J.基本的局部对齐搜索工具。gydF4y2BaJ. Mol.生物学。gydF4y2Ba215gydF4y2Ba, 403-410(1990)。gydF4y2Ba
Katoh K., Misawa K., Kuma K. & Miyata T. MAFFT:一种基于快速傅里叶变换的多序列快速对齐新方法。gydF4y2Ba核酸测定。gydF4y2Ba30.gydF4y2Ba, 3059-3066(2002)。gydF4y2Ba
Katoh, K. & Standley, D. M. MAFFT多序列比对软件版本7:性能和可用性的改进。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba30.gydF4y2Ba, 772-780(2013)。gydF4y2Ba
kaoh, K. & Toh, H.并行化的MAFFT多序列比对程序。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba1899-1900(2010)。gydF4y2Ba
Stamatakis, a . RAxML版本8:用于系统发育分析和大系统发育后分析的工具。gydF4y2Ba生物信息学gydF4y2Ba30.gydF4y2Ba, 1312-1313(2014)。gydF4y2Ba
傅丽玲,牛斌,朱智,吴松,李伟。CD-HIT:用于下一代测序数据聚类的加速技术。gydF4y2Ba生物信息学gydF4y2Ba28gydF4y2Ba, 3150-3152(2012)。gydF4y2Ba
Katoh, K., Kuma, K., Toh, H. & Miyata, T. MAFFT版本5:提高多序列对齐的准确性。gydF4y2Ba核酸测定。gydF4y2Ba33gydF4y2Ba, 511-518(2005)。gydF4y2Ba
Le S. Q. & Gascuel, O.一种改进的通用氨基酸替代基质。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba25gydF4y2Ba, 1307-1320(2008)。gydF4y2Ba
Soubrier, J.等。位点间速率异质性对分子速率时间依赖性的影响。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba29gydF4y2Ba, 3345-3358(2012)。gydF4y2Ba
杨哲。DNA序列演化的时空过程模型。gydF4y2Ba遗传学gydF4y2Ba139gydF4y2Ba, 993-1005(1995)。gydF4y2Ba
Anisimova, M., Gil, M., Dufayard, J. F., Dessimoz, C. & Gascuel, O.对分支支持方法的调查证明了基于可能性的快速逼近方案的准确性、威力和鲁棒性。gydF4y2Ba系统。医学杂志。gydF4y2Ba60gydF4y2Ba, 685-699(2011)。gydF4y2Ba
金登,S.等人。估计最大似然系统发生的新算法和方法:评估PhyML 3.0的性能。gydF4y2Ba系统。医学杂志。gydF4y2Ba59gydF4y2Ba, 307-321(2010)。gydF4y2Ba
明b.q,阮m.a.和冯·海塞勒,A.系统发育bootstrap的超快近似。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba30.gydF4y2Ba, 1188-1195(2013)。gydF4y2Ba
巴特耶,T. G., Kontogiannis, L.,约翰逊,O.,鲍威尔,H. R. &莱斯利,a . G. iMOSFLM:一种用于MOSFLM衍射图像处理的新图形界面。gydF4y2BaActa Crystallogr。DgydF4y2Ba67gydF4y2Ba, 271-281(2011)。gydF4y2Ba
埃文斯,p.r. & Murshudov, g.n.我的数据有多好,分辨率是多少?gydF4y2BaActa Crystallogr。DgydF4y2Ba69gydF4y2Ba, 1204-1214(2013)。gydF4y2Ba
Bunkoczi, G.等。移相器。MRage:自动分子替换。gydF4y2BaActa Crystallogr。DgydF4y2Ba69gydF4y2Ba, 2276-2286(2013)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.白骨顶的特征与发育。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
Liebschner, D.等人。使用x射线、中子和电子测定大分子结构:Phenix的最新进展。gydF4y2BaActa Crystallogr。DgydF4y2Ba75gydF4y2Ba, 861-877(2019)。gydF4y2Ba
麦考伊,A. J.等人。相位晶体学软件。gydF4y2Baj:。Crystallogr。gydF4y2Ba40gydF4y2Ba, 658-674(2007)。gydF4y2Ba
列别捷夫,A. A. & Isupov . M. N.大分子结构伪对称的空间群和起源模糊性及其Zanuda程序的处理。gydF4y2BaActa Crystallogr。DgydF4y2Ba70gydF4y2Ba, 2430-2443(2014)。gydF4y2Ba
Kowiel, M., Jaskolski, M. & Dauter, Z. ACHESYM:用于在单位细胞中标准化放置大分子模型的算法和服务器。gydF4y2BaActa Crystallogr。DgydF4y2Ba70gydF4y2Ba, 3290-3298(2014)。gydF4y2Ba
Szczepaniak, K., Bukala, A., da Silva Neto, A. M., Ludwiczak, J. & Dunin-Horkawicz, S.一个卷曲线圈域的库:从常规束到特殊扭转。gydF4y2Ba生物信息学gydF4y2Ba36gydF4y2Ba, 5368-5376(2020)。gydF4y2Ba
PyMOL分子图形系统,2.4版(Schrödinger, 2020)。gydF4y2Ba
乔万科瓦,E.等人。CAVER 3.0:动态蛋白质结构中运输途径分析的工具。gydF4y2Ba公共科学图书馆第一版。医学杂志。gydF4y2Ba8gydF4y2Ba, e1002708(2012)。gydF4y2Ba
Kagawa, R., Montgomery, M. G., Braig, K., Leslie, A. G. & Walker, J. E. ADP和氟化铍抑制牛f1 - atp酶的结构。gydF4y2BaEMBO J。gydF4y2Ba23gydF4y2Ba, 2734-2744(2004)。gydF4y2Ba
自动电子显微镜断层扫描使用样本运动的稳健预测。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba152gydF4y2Ba, 36-51(2005)。gydF4y2Ba
彼得森,E. F.等人。UCSF chimera -用于探索性研究和分析的可视化系统。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605-1612(2004)。gydF4y2Ba
Grant, T., Rohou, A. & Grigorieff, N. cisTEM,用户友好的单粒子图像处理软件。gydF4y2BaeLifegydF4y2Bahttps://doi.org/10.7554/eLife.35383gydF4y2Ba(2018)。gydF4y2Ba
用沉降速度超离心和lamm方程模型分析大分子的尺寸分布。gydF4y2BaBiophys。J。gydF4y2Ba78gydF4y2Ba1606-1619(2000)。gydF4y2Ba
用KinTek全球动力学探索者拟合酶动力学数据。gydF4y2BaEnzymol方法。gydF4y2Ba467gydF4y2Ba, 601-626(2009)。gydF4y2Ba
约翰逊,K. A.辛普森,Z. B. &布洛姆,T.全球动力学探索者:动力学模拟和动力学数据拟合的一种新的计算机程序。gydF4y2Ba分析的物化学。gydF4y2Ba387gydF4y2Ba, 20-29(2009)。gydF4y2Ba
程勇,李志刚,刘志刚。抑制常数(gydF4y2BaKgydF4y2Ba我gydF4y2Ba)和产生50%抑制作用的抑制剂的浓度(gydF4y2Ba我gydF4y2Ba50gydF4y2Ba)的酶促反应。gydF4y2Ba物化学。杂志。gydF4y2Ba22gydF4y2Ba, 3099-3108(1973)。gydF4y2Ba
确认gydF4y2Ba
D.K.和N.G.得到了霍华德休斯医学研究所(HHMI)的支持。我们要感谢M. Rigney在布兰代斯大学电子显微镜设备阴性染色数据收集方面的帮助,以及Z. Yu和Janelia研究园区低温电子显微镜设备的工作人员在数据收集方面的建议和帮助。伯克利结构生物学中心部分由HHMI支持。先进光源的Beamline 8.2.1,美国能源部科学用户设施办公室,合同编号为。DE-AC02-05CH11231是由美国国立卫生研究院、美国国家普通医学科学研究所资助的ALS-ENABLE计划的部分支持,授权P30 GM124169-01。质谱数据来自马萨诸塞大学质谱核心设施(RRID:SCR_019063)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
w.p., R.A.P.P.和D.K.构思了这个项目并设计了实验。W.P.执行并分析了所有生化数据。w。p。和r。a。p。准备好水晶托盘。R.A.P.P.收集并分析了x射线晶体学数据。W.P.为低温电镜研究准备了样品,并收集了阴性染色图像以筛选最佳样品条件。在n.g.r a.p.p.的监督下,T.G.收集并处理了所有的低温电磁数据,重建了低温电磁图,建立并解释了结构模型。W.P.和N.B.用放射性标记的KaiC进行了实验并进行了分析。M.H.建立了KaiC系统发生树。w.p., R.O.和D.K.写了这篇文章。所有作者都对手稿进行了评论,并对数据解释做出了贡献。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
D.K.是Relay Therapeutics和MOMA Therapeutics的联合创始人。其余作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Marta Carroni、Satchidananda Panda和其他匿名审稿人对这项工作的同行评议所作的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1gydF4y2BakaiCgydF4y2Ba和序列比对gydF4y2BakaiCgydF4y2Ba子组。gydF4y2Ba
(一)gydF4y2Ba的系统发育树gydF4y2BakaiCgydF4y2Ba同源染色体,gydF4y2BakaiCgydF4y2Bac端延伸约50个氨基酸的基因用红色标记。gydF4y2BaRhodobacter sphaeroidesgydF4y2Ba我们研究了菌株KD131gydF4y2Ba聚球藻属elongatusgydF4y2BaPCC 7942(在文献中被广泛研究)分别以绿色和粉红色突出显示。登录代码和生物体显示在分支的顶端,每个节点上的数字表示aBayes引导值gydF4y2Ba48gydF4y2Ba,并显示分支长度图例(请参阅补充数据集)gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).gydF4y2Ba(b)gydF4y2Ba的CII域的序列对齐gydF4y2BakaiCgydF4y2Ba子组用其序列相似性进行注释。残留Glu490,在截断的KaiC中引入停止密码子的位置gydF4y2BaRSgydF4y2Ba-Δcoil构造以红色显示,并用箭头标记。gydF4y2Ba
图2 KaiC的自磷酸化和核苷酸交换率。gydF4y2Ba
(一)gydF4y2Ba10% 3.5 μM KaiC SDS-PAGE凝胶gydF4y2BaRSgydF4y2Ba在30°C下使用ATP回收系统。U、S和D分别代表未磷酸化、单磷酸化和双磷酸化的KaiCgydF4y2BaRSgydF4y2Ba,分别。gydF4y2Ba(b)gydF4y2Ba从图(a)中对自磷酸化(单磷酸化+双磷酸化)随时间的密度分析得出6.5±1.0 h的速率gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba(c)gydF4y2Ba6.5% 3.5 μM KaiC SDS-PAGE凝胶gydF4y2BaSEgydF4y2Ba在1.2 μM KaiA的存在下gydF4y2BaSEgydF4y2Ba和4 mM ATP在30°C。U和P代表未磷酸化和磷酸化的KaiCgydF4y2BaSEgydF4y2Ba,分别。gydF4y2Ba(d)gydF4y2BaKaiC自磷酸化的密度分析gydF4y2BaSEgydF4y2BaKaiA激活gydF4y2BaSEgydF4y2Ba(面板(c))显示速率为0.40±0.02 hgydF4y2Ba−1gydF4y2Ba而且比KaiC慢得多gydF4y2BaRSgydF4y2Ba.(b)和(d)参数的标准差由数据拟合得到。gydF4y2Ba(e)gydF4y2Ba10% SDS-PAGE凝胶在3.5 μM KaiC条件下进行实验gydF4y2BaRSgydF4y2Ba在20 - 35℃之间使用ATP循环系统,并在4 mM ATP存在的情况下,磷酸化水平随着温度的升高而升高。U、S和D分别代表未磷酸化、单磷酸化和双磷酸化的KaiCgydF4y2BaRSgydF4y2Ba,分别。(a)、(c)、(e)中凝胶源数据见补充图gydF4y2Ba2gydF4y2Ba.gydF4y2Ba(f)gydF4y2Ba显示KaiC CII域内核苷酸交换率的柱状图gydF4y2BaRSgydF4y2Ba在ATP循环体系存在下,用50 μM ATP孵育,然后与250 μM mant-ATP混合。记录了在440 nm处荧光强度的增加,并拟合了单指数时间迹线,以获得交换速率常数:3.6±0.8 hgydF4y2Ba−1gydF4y2Ba(20°C), 12.2±1.0 hgydF4y2Ba−1gydF4y2Ba(25°C), 18.5±1.5 hgydF4y2Ba−1gydF4y2Ba(30℃),25.2±0.2 hgydF4y2Ba−1gydF4y2Ba(35°C)。实验一式三次,数据以平均值±s.d表示。gydF4y2Ba
图3 KaiC的寡聚态gydF4y2BaRSgydF4y2Ba以及螺旋结构域对核苷酸交换速率和自磷酸化的影响。gydF4y2Ba
(一)gydF4y2BaKaiC的寡聚分析gydF4y2BaRSgydF4y2Ba(绿线为十二碳分子)和截断的KaiCgydF4y2BaRSgydF4y2Ba-Δcoil(六聚体,青色线)通过分析凝胶过滤色谱。蛋白质大小标记显示在顶部。gydF4y2Ba(b)gydF4y2BaKaiC洗脱谱的比较gydF4y2BaRSgydF4y2Ba-Δcoil(青色线)和KaiCgydF4y2BaSEgydF4y2Ba尺寸排除色谱(紫色线)显示两种KaiC均为六聚体状态gydF4y2BaRSgydF4y2Ba-Δcoil和KaiCgydF4y2BaSEgydF4y2Ba.gydF4y2Ba(c)gydF4y2BaKaiC的寡聚态gydF4y2BaRSgydF4y2Ba(绿线),KaiCgydF4y2BaRSgydF4y2Ba-Δcoil(六聚体,青色线)和KaiCgydF4y2BaSEgydF4y2Ba(六聚体,紫色线)也通过分析超离心(沉积速度为30000 rpm, 20°C)进行了测量,结果与图(a)和图(b)所示数据一致。图(C)中的图表代表了沉积系数的分布[C (s)]。gydF4y2Ba(d)gydF4y2Ba440nm处的荧光变化(ΔFgydF4y2Ba440海里gydF4y2Ba)表示KaiC在30°C时ATP和mant-ATP之间的核苷酸交换gydF4y2BaRSgydF4y2Ba(绿色痕迹,18.0±1.5 hgydF4y2Ba−1gydF4y2Ba)及KaiCgydF4y2BaRSgydF4y2Ba-Δcoil(青色痕迹,19.1±0.8小时gydF4y2Ba−1gydF4y2Ba).有代表性的痕迹显示和拟合参数(平均值±s.d)从三个重复测量获得。gydF4y2Ba(e)gydF4y2Ba锌gydF4y2Ba2 +gydF4y2BaPhos-taggydF4y2BaTMgydF4y2BaSDS-PAGE凝胶显示了KaiC随时间的磷酸化水平gydF4y2BaRSgydF4y2Ba(上凝胶)和KaiCgydF4y2BaRSgydF4y2Ba-Δcoil(下凝胶)在35°C。P和U分别代表磷酸化和未磷酸化的蛋白质。gydF4y2Ba(f)gydF4y2BaKaiC磷酸化水平随时间的变化gydF4y2BaRSgydF4y2Ba(绿圈,7.4±0.3小时gydF4y2Ba−1gydF4y2Ba)及KaiCgydF4y2BaRSgydF4y2Ba-Δcoil(青色圆,5.5±0.4小时gydF4y2Ba−1gydF4y2Ba)用密度法分析锌gydF4y2Ba2 +gydF4y2BaPhos-taggydF4y2BaTMgydF4y2Ba(e)中SDS-PAGE凝胶。gydF4y2Ba(g)gydF4y2Ba未磷酸化KaiC热稳定性曲线的一阶导数gydF4y2BaRSgydF4y2Ba与ADP结合(棕色线)并磷酸化KaiCgydF4y2BaRSgydF4y2Ba与ATP结合(绿线)。提取的变性温度为50°C(未磷酸化的KaiCgydF4y2BaRSgydF4y2Ba在1 mM ADP的存在下)和58°C(磷酸化KaiCgydF4y2BaRSgydF4y2Ba在1mm ATP存在的情况下),分别。gydF4y2Ba(h)gydF4y2Ba未磷酸化KaiC的十二羧基状态gydF4y2BaRSgydF4y2Ba(40 μM)与ADP结合,采用尺寸排除色谱法测定。gydF4y2Ba(我)gydF4y2BaSDS-PAGE凝胶显示,在4 mM ADP存在的情况下,在30°C下,Ser413随时间发生去磷酸化(U和pSer413代表未磷酸化和Ser413磷酸化的KaiCgydF4y2BaRSgydF4y2Ba,分别),对应的动力学如图所示(经MS/MS确认),速率常数为11.5±0.8 hgydF4y2Ba−1gydF4y2Ba.这一结果表明,线圈结构域促进了KaiCgydF4y2BaRSgydF4y2Ba去磷酸化。(e)和(i)中凝胶源数据见补充图gydF4y2Ba2gydF4y2Ba.(f)和(i)参数的标准差由数据拟合得到。gydF4y2Ba
扩展数据图4冷冻电子显微镜处理流程和最终十二聚体结构验证的图形化描述。gydF4y2Ba
工作流(参见方法部分的描述)演示了一个典型的图像(比例尺:60 nm)和具有代表性的优秀类平均值。从头算和最终重建显示。与最终重建一起显示的是演示粒子视图分布的角图和用于全局分辨率估计的傅里叶壳相关曲线gydF4y2Ba(一)gydF4y2BaKaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E单独和gydF4y2Ba(b)gydF4y2BaKaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E: KaiBgydF4y2BaRSgydF4y2Ba复杂。为了验证最终组合的十二聚体结构,对完整十二聚体的数据进行了重新处理。图中显示了具有代表性的良类平均、最终重构、角分布和傅里叶壳的相关曲线gydF4y2Ba(c)gydF4y2BaKaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E单独和gydF4y2Ba(d)gydF4y2BaKaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E: KaiBgydF4y2BaRSgydF4y2Ba复杂的dodecamers。gydF4y2Ba(e)gydF4y2Ba比较gydF4y2BaCgydF4y2Ba1,gydF4y2BaDgydF4y2Ba6个KaiC重建图gydF4y2BaRSgydF4y2Ba-S413E/S414E单独和KaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E: KaiBgydF4y2BaRSgydF4y2Ba的傅里叶壳层相关曲线gydF4y2BaCgydF4y2Ba1重建。的gydF4y2BaCgydF4y2Ba1/gydF4y2BaDgydF4y2Ba6比较没有揭示出可辨别的差异,表明这些复合体有gydF4y2BaDgydF4y2Ba6对称。gydF4y2Ba
图5 KaiC CII区卷曲线圈寄存器移位与磷酸化的相关性及连续磷酸化/去磷酸化事件的模型gydF4y2BaRSgydF4y2Ba.gydF4y2Ba
(一)gydF4y2BaKaiC的结构比较gydF4y2BaRSgydF4y2Ba(绿色)和KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E(橙色,为清晰起见,单链)揭示了拟磷结构中的线圈指向外,与KaiC的角度约为20°gydF4y2BaRSgydF4y2Ba卷曲螺旋。gydF4y2Ba(b)gydF4y2Ba线圈结构域的构象变化影响了二聚体界面,因为与相反的六聚体交换了伙伴(另见图)。gydF4y2Ba2gydF4y2Ba).从“外部视角”:KaiC中的c端螺旋gydF4y2BaRSgydF4y2Ba与右边的六聚体相互作用,而在KaiC中gydF4y2BaRSgydF4y2Ba-S413E/S414E与左边的链条相互作用。gydF4y2Ba(c)gydF4y2Ba线圈图描述了伴随这种结构重排的七阶寄存器移位。gydF4y2Ba(d)gydF4y2Ba基于我们结构的叠加,我们提出了以下磷酸化/去磷酸化事件的模型。首先,磷酸化循环开始于ATP的γ-磷酸转移到Ser414的羟基(1;绿色箭头)中未磷酸化的KaiCgydF4y2BaRSgydF4y2Ba(绿色)或KaiCgydF4y2BaRSgydF4y2BaΔ线圈(青色)。其次,KaiC的pSer414gydF4y2BaRSgydF4y2Ba-Δcoil(紫色,单磷酸化)远离活性位点,使Ser413的羟基更靠近ATP的γ-磷酸进行第二次磷酸化(2;紫色箭头)。第三,双拟磷态(KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E,橙色)表明pSer414的磷酸化基移回活性位点进行去磷酸化(3;橙色箭头)。最后,我们假设Trp419的吲哚基团“推动”pSer413进入活性位点进行第二次去磷酸化事件(虚线箭头),这与KaiC中观察到的较慢的去磷酸化速率一致gydF4y2BaRSgydF4y2Ba-Δcoil构造(gydF4y2BacfgydF4y2Ba.无花果。gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
图6 atp - adp比值对KaiC的影响gydF4y2BaRSgydF4y2Ba自脱磷酸化以及温度和KaiB的依赖性gydF4y2BaRSgydF4y2Ba与KaiC的atp酶活性相关gydF4y2BaRSgydF4y2Ba.gydF4y2Ba
(一)gydF4y2Ba10% 3.5 μM KaiC SDS-PAGE凝胶gydF4y2BaRSgydF4y2Ba3.5 μM KaiBgydF4y2BaRSgydF4y2Ba在30°C下,4 mM ATP和10 mM 2-磷酸烯醇丙酮酸的存在表明,加入2 U ml ATP后,自磷酸化循环重新开始gydF4y2Ba−1gydF4y2Ba丙酮酸激酶。gydF4y2Ba(b)gydF4y2Ba10% 3.5 μM KaiC SDS-PAGE凝胶gydF4y2BaRSgydF4y2Ba不安装(上面板)3.5 μM KaiB(下面板)gydF4y2BaRSgydF4y2Ba在4 mM ATP存在的情况下,从一开始就添加了ATP回收系统,表明在这些条件下KaiB不会加速去磷酸化。(a)和(b)中凝胶源数据见补充图gydF4y2Ba2gydF4y2Ba.gydF4y2Ba(c)gydF4y2BaKaiC生产ADP的代表性曲线gydF4y2BaRSgydF4y2Ba(3.5 μM)单独和gydF4y2Ba(d)gydF4y2BaKaiB在场gydF4y2BaRSgydF4y2BaHPLC法测定4mm ATP中(3.5 μM)的含量。数据分析如方法部分所述,结果atp酶活性为108±10天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba(KaiBgydF4y2BaRSgydF4y2Ba= 176±29天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba), 20℃,163±16天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba(KaiBgydF4y2BaRSgydF4y2Ba= 1052±143天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba), 25°C, 208±19天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba(KaiBgydF4y2BaRSgydF4y2Ba= 1557±172天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba) 30℃,300±21天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba(KaiBgydF4y2BaRSgydF4y2Ba= 2584±245天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba)在35°C。温度系数,gydF4y2Ba问gydF4y2Ba10克ydF4y2Ba,利用在25°C和35°C下获得的数据进行计算,得到~ 1.9。每个温度下atp酶活性的标准偏差(右图)是从三次重复测量中获得的,数据以平均值±s.d表示。gydF4y2Ba(e)gydF4y2BaKaiC生产ADP的比较gydF4y2BaRSgydF4y2Ba在KaiB不存在(橙色圆圈,面板(c)数据)和存在(橙色菱形,面板(d)数据)的情况下gydF4y2BaRSgydF4y2Ba在30°C时,复合物的atp酶活性增加了7.5倍。KaiB的结合gydF4y2BaRSgydF4y2Ba加速KaiC的atp酶活性gydF4y2BaRSgydF4y2Ba在CI和CII领域(参见扩展数据图。gydF4y2Ba8 b, cgydF4y2Ba).gydF4y2Ba(f)gydF4y2BaKaiC的SDS-PAGE凝胶gydF4y2BaRSgydF4y2Ba(10 μg)和KaiBgydF4y2BaRSgydF4y2Ba(10 μg)表明两种蛋白均被纯化至均一性,因此检测到的atp酶活性不是由杂质引起的。gydF4y2Ba(g)gydF4y2BaKaiB的ADP生产gydF4y2BaRSgydF4y2Ba正如预期的那样,在30°C的4mm ATP中,KaiB没有ATP酶活性gydF4y2BaRSgydF4y2Ba并证实图(d)所示的atp酶活性的增加是由于复合物的形成。图(c-d,左)、e和g所示代表性曲线的标准偏差设置为6%,假设最大的系统误差来自注入器。gydF4y2Ba
图7 KaiC去磷酸化gydF4y2BaRSgydF4y2Ba通过atp合酶机制发生,磷酸化转移步骤不受KaiB结合的影响gydF4y2BaRSgydF4y2Ba.gydF4y2Ba
(一)gydF4y2Ba可能的机制如何KaiBgydF4y2BaRSgydF4y2Ba可以加速KaiCgydF4y2BaRSgydF4y2Ba在夜间去磷酸化。KaiB的结合gydF4y2BaRSgydF4y2Ba在CI上gydF4y2BaRSgydF4y2Ba结构域直接加速磷酸基从pSer向结合的ADP转移,从而产生瞬时结合的ATP。该图表示CII中两个单体之间的界面gydF4y2BaRSgydF4y2Ba域。gydF4y2Ba(b)gydF4y2Ba放射自显影分离gydF4y2Ba32gydF4y2BaP-KaiCgydF4y2BaRSgydF4y2Ba在Ser413,瞬态形成gydF4y2Ba32gydF4y2BaP-ATP和游离的gydF4y2Ba32gydF4y2Ba通过薄层色谱(TLC)与4 mM ADP在30°C,相应的动力学示于gydF4y2Ba(c)gydF4y2Ba其中,灰色圆圈、紫色三角形和青色菱形代表磷酸化的相对浓度gydF4y2Ba32gydF4y2BaP-KaiCgydF4y2BaRSgydF4y2Ba,gydF4y2Ba32gydF4y2BaP-ATP和游离的gydF4y2Ba32gydF4y2Baπ,分别。gydF4y2Ba(d)gydF4y2Ba暂态比较gydF4y2Ba32gydF4y2BaKaiB不存在(开放三角形)和存在(实心三角形)时P-ATP的形成和衰减gydF4y2BaRSgydF4y2Ba和自由gydF4y2Ba32gydF4y2BaP在不存在KaiB和存在KaiB的情况下形成gydF4y2BaRSgydF4y2Ba(实心圆圈)。瞬态衰减更快gydF4y2Ba32gydF4y2BaP-ATP和高游离gydF4y2Ba32gydF4y2Ba在KaiB存在下P的产生gydF4y2BaRSgydF4y2Ba表明KaiBgydF4y2BaRSgydF4y2Ba加速KaiC中的水解gydF4y2BaRSgydF4y2Ba.gydF4y2Ba(e)gydF4y2BaSDS-PAGE凝胶(10%)脱磷酸化3.5 μM KaiC磷酸化gydF4y2BaRSgydF4y2Ba在Ser413位点,不使用3.5 μM KaiB(上凝胶),使用3.5 μM KaiB(下凝胶)gydF4y2BaRSgydF4y2Ba在30℃条件下,加入4mm ADP(凝胶源数据见补充图)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba(f)gydF4y2Ba面板(e)中数据的密度分析显示了总KaiC的衰减gydF4y2BaRSgydF4y2Ba在KaiB缺失(灰色圆圈)和存在(红色菱形)时磷酸化gydF4y2BaRSgydF4y2Ba产率为11.5±0.8 hgydF4y2Ba−1gydF4y2Ba11.0±0.8 hgydF4y2Ba−1gydF4y2Ba,分别。这一结果表明KaiB的结合gydF4y2BaRSgydF4y2Ba不会加速KaiC中的磷酸化转移步骤gydF4y2BaRSgydF4y2Ba.gydF4y2Ba
图8 KaiB的效果gydF4y2BaRSgydF4y2Ba在KaiC的CII区域结合atp酶活性和核苷酸交换gydF4y2BaRSgydF4y2Ba.gydF4y2Ba
(一)gydF4y2Ba第二种可能的机制解释了KaiB如何gydF4y2BaRSgydF4y2Ba加速KaiCgydF4y2BaRSgydF4y2Ba在夜间去磷酸化gydF4y2Ba:gydF4y2BaKaiB结合gydF4y2BaRSgydF4y2Ba到CIgydF4y2BaRSgydF4y2Ba结构域可以提高CII的水解速率gydF4y2BaRSgydF4y2Ba结构域,从而防止磷酸基从瞬时形成转移回或外部ATP返回到丝氨酸残基。gydF4y2Ba(b)gydF4y2Ba磷酸化KaiC生产ADP的代表曲线gydF4y2BaRSgydF4y2Ba与CI域的催化突变(KaiCgydF4y2BaRSgydF4y2Ba-E62Q/E63Q, 3.5 μM)在3.5 μM KaiB不存在(深绿色圆圈)和存在(浅绿色圆圈)的情况下gydF4y2BaRSgydF4y2Ba在30°C和4 mM ATP用HPLC定量。从这些数据来看,atp酶活性在CII区域为112±8天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba195±16天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2BaKaiB在场gydF4y2BaRSgydF4y2Ba是确定。gydF4y2Ba(c)gydF4y2Ba用高效液相色谱法测量ADP产量的代表曲线见KaiC的图(b)gydF4y2BaRSgydF4y2Ba但在CII结构域(KaiC)有催化突变gydF4y2BaRSgydF4y2Ba-E302Q/E303Q, 3.5 μM)中不存在3.5 μM KaiB(深粉色圆圈)和存在3.5 μM KaiB(浅粉色钻石)gydF4y2BaRSgydF4y2Ba.CI区相应的atp酶活性为110±12天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2Ba在缺席和320±22天gydF4y2Ba−1gydF4y2BaKaiCgydF4y2Ba−1gydF4y2BaKaiB在场gydF4y2BaRSgydF4y2Ba.gydF4y2Ba(d)gydF4y2BaKaiCI生产ADP的代表曲线gydF4y2BaRSgydF4y2Ba-E62Q/E63Q(仅构造有催化突变的CI结构域)在30°C的4mm ATP中没有ATP酶活性,这表明Glu62和Glu63是KaiC CI结构域中唯一负责ATP酶活性的两个残基gydF4y2BaRSgydF4y2Ba并确认图b所示的atp酶活性是由于KaiC CII结构域的atp酶活性gydF4y2BaRSgydF4y2Ba.面板(b-d)中所示的代表性曲线的标准偏差设置为6%,假设最大的系统误差来自注入器。图(b-d)中的实验进行了三次,图中图(b)和图(c)中的atp酶率表示为平均值±s.d。gydF4y2Ba(e)gydF4y2Ba第三种可能的机制是如何解释KaiBgydF4y2BaRSgydF4y2Ba加速KaiCgydF4y2BaRSgydF4y2Ba夜间去磷酸化:结合KaiBgydF4y2BaRSgydF4y2Ba到CIgydF4y2BaRSgydF4y2Ba结构域可以促进CII中更快的核苷酸交换gydF4y2BaRSgydF4y2Ba由ADP取代瞬时ATP的结构域。gydF4y2Ba(f)gydF4y2Ba由于mant-ATP与KaiC结合,荧光强度在440 nm的时间过程gydF4y2BaRSgydF4y2Ba-S413E在KaiB不存在(蓝色实线)和存在(红色虚线)时与ATP结合gydF4y2BaRSgydF4y2Ba.KaiCgydF4y2BaRSgydF4y2Ba-S413E (3.5 μM)用3.5 μM KaiB预孵育gydF4y2BaRSgydF4y2Ba在50 μM ATP和ATP循环系统的存在下,在20、25、30和35°C孵育16 h,然后与250 μM mant-ATP混合。表中列出了在每种温度下观测到的汇率gydF4y2Ba(g)gydF4y2Ba.gydF4y2Ba(h)gydF4y2BaKaiCI的核苷酸交换gydF4y2BaRSgydF4y2Ba(即只有CIgydF4y2BaRSgydF4y2Ba结构域)不能测量,因为在核苷酸结合位点附近没有色氨酸残留。总之,KaiBgydF4y2BaRSgydF4y2Ba加速KaiCgydF4y2BaRSgydF4y2Ba通过增加CI和CII结构域的水解速率来实现去磷酸化,并且不影响核苷酸交换率。(f)、(h)和拟合参数(g;均值±s.d)由三次重复测量获得。gydF4y2Ba
图9 KaiBC中的KaiB-KaiB接口gydF4y2BaRSgydF4y2Ba配合物影响溶剂进入KaiC活性位点的可能性gydF4y2BaRSgydF4y2Baci。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba) KaiB的阻垢层析gydF4y2BaRSgydF4y2Ba(蓝色)表示与KaiB相比,它在溶液中是单体gydF4y2BaSEgydF4y2Ba(灰色),以四聚体的形式洗脱。色谱图上方显示的是分子量标准。gydF4y2Ba(b)gydF4y2BaKaiB的结构比较gydF4y2BaTEgydF4y2Ba(灰色,PDB 5jwqgydF4y2Ba26gydF4y2Ba)及KaiBgydF4y2BaRSgydF4y2Ba(蓝色)与对应的KaiC六聚体结合。PISA软件包gydF4y2Ba37gydF4y2Ba决定了KaiBCgydF4y2BaTEgydF4y2Ba使KaiB之间的接口变得复杂gydF4y2BaTEgydF4y2Ba单体是255 ÅgydF4y2Ba2gydF4y2Ba,而KaiB之间的平均界面gydF4y2BaRSgydF4y2Ba单体只有45 ÅgydF4y2Ba2gydF4y2Ba在KaiBCgydF4y2BaRSgydF4y2Ba复杂。gydF4y2Ba(c)gydF4y2Ba要了解KaiBgydF4y2BaRSgydF4y2Ba与KaiC绑定gydF4y2BaRSgydF4y2Ba-CI结构域增加了水解速率,我们研究了构象变化是否调节底物对活性位点的访问。CAVER软件gydF4y2Ba61gydF4y2Ba用于计算通向KaiC ? CI域活动部位的隧道(灰色网格)gydF4y2BaRSgydF4y2Ba-S413E/S414E单独(橙色)和KaiCgydF4y2BaRSgydF4y2Ba-S413E / S414E: KaiBgydF4y2BaRSgydF4y2Ba具有不同探测半径的复合物(黄:蓝)。在两种结构中,活性位点均被ADP:Mg所占据gydF4y2Ba2 +gydF4y2Ba(分别是木棍和绿色球体)。牛f1 - atp酶的晶体结构与过渡态类似物(PDBgydF4y2Ba1 w0jgydF4y2Ba选项D。gydF4y2Ba62gydF4y2Ba用作参考,以确定催化水分子在活性位点的位置(显示为红色球体)。当KaiB时,计算的隧道将溶剂与催化水连接在一起gydF4y2BaRSgydF4y2Ba在探测半径大于默认值0.9 Å时绑定,但在没有该值时从不绑定。这些结果表明KaiBgydF4y2BaRSgydF4y2Ba方便水进入KaiC的活动场地gydF4y2BaRSgydF4y2Ba-CI通过长程构象变化,从而增强ATP水解。gydF4y2Ba
扩展数据图10 KaiBgydF4y2BaRSgydF4y2Ba优先与KaiC的水解后状态结合gydF4y2BaRSgydF4y2Ba并影响其稳定性。gydF4y2Ba
(一)gydF4y2Ba50 μM KaiC阻垢层析gydF4y2BaRSgydF4y2Ba可信区间(CIgydF4y2BaRSgydF4y2Ba区域)中存在50 μM KaiB(黑线,六聚体)和(灰线,单体)gydF4y2BaRSgydF4y2Ba在1mm ATP缓冲液中。gydF4y2Ba(b)gydF4y2Ba50 μM KaiC阻垢层析gydF4y2BaRSgydF4y2Ba在50 μM KaiB存在的情况下,-ΔcoilgydF4y2BaRSgydF4y2Ba(紫色)。参考样品(50 μM KaiC)gydF4y2BaRSgydF4y2Ba-Δcoil)是溶液中的六聚体(青色),在加入50 μM KaiB后gydF4y2BaRSgydF4y2Ba混合物在30℃下孵卵3.5小时(紫色),然后在4℃的Superdex-200 10/300 GL色谱柱上再次运行样品。这些数据表明KaiB的结合gydF4y2BaRSgydF4y2Ba导致(i)六聚体KaiC的分解gydF4y2BaRSgydF4y2Ba-Δcoil结构转化为单体和(ii)通过洗脱在柱的空隙体积中检测到的聚合(vgydF4y2Ba0gydF4y2Ba).gydF4y2Ba(c)gydF4y2BaKaiC的热变性剖面gydF4y2BaRSgydF4y2Ba-S413E/S414E在1mm ADP的存在下显示为从深蓝色到浅蓝色,以增加KaiB的浓度gydF4y2BaRSgydF4y2Ba(0 ~ 4 μM)。黑线代表KaiBgydF4y2BaRSgydF4y2Ba(15 μM),由于缺乏疏水核心,不与SYPRO Orange结合,因此没有荧光信号。TgydF4y2Ba米gydF4y2Ba随着KaiB的加入而降低gydF4y2BaRSgydF4y2Ba,表明KaiB的结合gydF4y2BaRSgydF4y2Ba破坏KaiC的稳定gydF4y2BaRSgydF4y2Badodecamer。可能是由于界面和KaiC的松动gydF4y2BaRSgydF4y2Ba结构,从而允许形成一个隧道,将散装溶剂连接到活性部位的水解水的位置(见扩展数据图)。gydF4y2Ba9gydF4y2Ba).gydF4y2Ba(d)gydF4y2BaSDS-PAGE分析显示了下拉试验的对照实验。分子量标记后的前四道是KaiBgydF4y2BaRSgydF4y2Ba-标记样品(红色箭头)并显示KaiBgydF4y2BaRSgydF4y2Ba-Tag与列紧密绑定。最后四个通道是KaiC的对照下拉实验gydF4y2BaRSgydF4y2Ba(绿色箭头)并显示KaiCgydF4y2BaRSgydF4y2Ba单独无法绑定到列。这些通道分别表示下拉实验中使用的初始样品(Before),将样品加载到色谱柱上后的流过(FT),用结合缓冲液洗涤色谱柱三次后的流过(洗涤#3),以及用咪唑洗脱后的样品(洗脱)。(gydF4y2BaegydF4y2Ba) SDS-PAGE分析下拉法测定KaiB之间的络合物形成gydF4y2BaRSgydF4y2Ba-标签和野生型KaiCgydF4y2BaRSgydF4y2Ba, KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E,或KaiCgydF4y2BaRSgydF4y2Ba-S413A/S414A存在4毫米ADP或ATP(与ATP回收系统)。凝胶源数据参见补充图gydF4y2Ba2gydF4y2Ba.gydF4y2Ba(f)gydF4y2Ba野生型KaiC百分比gydF4y2BaRSgydF4y2Ba绑定到KaiBgydF4y2BaRSgydF4y2Ba-标签蛋白的不同atp - adp比(4 mM总核苷酸浓度)在25°C下拉试验测量。gydF4y2Ba(g)gydF4y2Ba未标记KaiB在30°C下的荧光各向异性gydF4y2BaRSgydF4y2Ba竞争性地取代荧光团标记的KaiBgydF4y2BaRSgydF4y2Ba(KaiBgydF4y2BaRSgydF4y2Ba-6IAF)来自KaiCgydF4y2BaRSgydF4y2Ba-S413E/S414E在4毫米ADP存在时(红圈,gydF4y2BaKgydF4y2BaDgydF4y2Ba值为0.79±0.06 μM)和4 mM ATP循环系统(橙色三角形)。在后面的实验中,没有观察到各向异性的变化,这表明只有一小部分KaiBgydF4y2BaRSgydF4y2Ba-6IAF在这些条件下是绑定的。计算了10次重复测量的平均各向异性和标准误差。gydF4y2Ba(h)gydF4y2Bamant- atp - γ s或mant-ADP释放用柱状图表示,观察速率为4.8±0.2 hgydF4y2Ba−1gydF4y2Ba43.6±3.0 hgydF4y2Ba−1gydF4y2Ba对KaiC释放man - atp - γ s和man - adp的影响gydF4y2BaRSgydF4y2Ba-S413E/S414E,分别为21.0±3.0 hgydF4y2Ba−1gydF4y2Ba65±15 hgydF4y2Ba−1gydF4y2Ba对KaiC释放man - atp - γ s和man - adp的影响gydF4y2BaRSgydF4y2Ba分别-S413A / S414A。结果表明了KaiC的CII域gydF4y2BaRSgydF4y2Ba更倾向于结合ATP而不是ADP。(f)和(h)组的实验进行了三次,数据以平均值±s.d表示。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
补充图1、2和补充表1、2。gydF4y2Ba
补充视频1gydF4y2Ba
KaiC CII区域构象变化的可视化gydF4y2BaRSgydF4y2Ba经过长链变构网络磷酸化后。通过未磷酸化的KaiC之间的线性插值来制作弹道gydF4y2BaRSgydF4y2Ba拟磷型(KaiC)gydF4y2BaRSgydF4y2Ba-S413E/S414E)使用变形工具在UCSF Chimera 1.15(参考。gydF4y2Ba64gydF4y2Ba);电影是用PyMOL (v.2.6.0)渲染的gydF4y2Ba60gydF4y2Ba.gydF4y2Ba
补充数据1gydF4y2Ba
KaiC的初始多序列比对和系统发育树。gydF4y2Ba
补充数据2gydF4y2Ba
最终的多序列比对和系统发育树只包括含有KaiB和KaiC的物种。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
皮特萨旺,W., Pádua, r.a.p.,格兰特,T.。gydF4y2Baet al。gydF4y2Ba从原始时钟到昼夜节律振荡器。gydF4y2Ba自然gydF4y2Ba(2023)。https://doi.org/10.1038/s41586-023-05836-9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-023-05836-9gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba