摘要gydF4y2Ba
囊性纤维化跨膜电导调节因子(CFTR)是一种阴离子通道,调节盐和液体在上皮膜上的稳态gydF4y2Ba1gydF4y2Ba.CFTR的改变会导致囊性纤维化,这是一种无法治愈的致命疾病gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.CFTR的电生理特性已经被分析了几十年gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.CFTR的结构以两种全球不同的构象确定,强调了它与其他atp结合盒式转运蛋白的进化关系。然而,CFTR的基本功能与现有结构之间的直接关联目前还缺乏。在这里,我们结合集成功能测量,单分子荧光共振能量转移,电生理学和动力学模拟,表明人类CFTR的两个核苷酸结合域(NBDs)在通道打开之前二聚。CFTR表现出一种变构门控机制,其中nbd二聚通道内的构象变化受ATP水解控制,调节氯离子电导。当nbd二聚时,增强剂ivacaftor和GLPG1837通过增加孔开度来增强通道活性。ATPase位点近端(G551D)或远端(L927P)的致病取代都降低了NBD二聚体的效率。这些发现共同促成了一种门控机制的框架,为寻找更有效的临床治疗提供了信息。gydF4y2Ba
主要gydF4y2Ba
CFTR属于蛋白质的atp结合盒转运蛋白家族,但独特的功能作为离子通道gydF4y2Ba4gydF4y2Ba.它由两个跨膜结构域组成,形成离子渗透途径,两个结合并水解ATP的胞质nbd,以及一个胞质调节(R)结构域,包括几个磷酸化位点。几十年的电生理、生化和结构研究(在参考文献中进行了回顾。gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba)证实CFTR活性需要蛋白激酶A (PKA)对R结构域的磷酸化。gydF4y2Ba7gydF4y2Ba.一旦磷酸化,ATP结合驱动毛孔打开。CFTR包含两个功能不同的atp结合位点gydF4y2Ba8gydF4y2Ba.“共识”位点具有催化能力,而“退化”位点则不然gydF4y2Ba9gydF4y2Ba.ATP在一致位点水解导致孔隙关闭gydF4y2Ba10gydF4y2Ba.在缺乏ATP的情况下,孔隙会打开,而非水解性孔隙会关闭,尽管这种情况很少发生gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
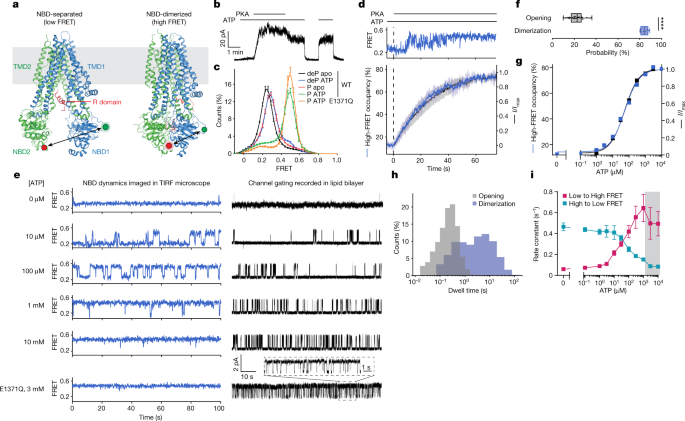
到目前为止,CFTR的低温电子显微镜(cryo-EM)研究揭示了两种全球不同的构象。在没有磷酸化和ATP的情况下,CFTR形成孔闭构象,其中NBD相隔约20 Å, R结构域在空间上阻止了NBD二聚gydF4y2Ba13gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba).磷酸化和atp结合的CFTR,使用水解缺陷的E1371Q变体进行结构表征gydF4y2Ba14gydF4y2Ba,表现出水解前构象,其中nbd形成一个封闭的二聚体,两个ATP分子结合在它们的界面(图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,去磷酸化的CFTR结构,无atp(左,蛋白质数据库gydF4y2Ba5 uakgydF4y2Ba)和磷酸化,atp结合(右,蛋白质数据库gydF4y2Ba6男男同性恋者gydF4y2Ba)状态。绿色和红色圆圈表示荧光团的位置。gydF4y2BabgydF4y2Ba,由内向外切除的斑块显示野生型(WT) cftr介导的电流对磷酸化和ATP的依赖性。浓度为300 nM PKA和3 mM ATP。gydF4y2BacgydF4y2Ba,去磷酸化(deP)和磷酸化(P)野生型CFTR的FRET直方图gydF4y2Ba烦恼gydF4y2Ba在ATP存在和不存在的情况下,并磷酸化CFTRgydF4y2Ba烦恼gydF4y2Ba(E1371Q)与ATP结合。数据表示的均值和标准误差gydF4y2BangydF4y2Ba独立的实验。gydF4y2BangydF4y2Ba野生型去磷酸化和磷酸化载脂蛋白= 6,gydF4y2BangydF4y2BaATP脱磷野生型= 5,gydF4y2BangydF4y2BaATP磷酸化的野生型= 7gydF4y2BangydF4y2BaATP磷酸化的E1371Q = 3。gydF4y2BadgydF4y2Ba,在3 mM ATP存在的情况下,应用300 nM PKA(在虚线处)后,孔隙开放激活和高fret状态的占用增加。上面板,CFTR代表性smFRET痕迹gydF4y2Ba烦恼gydF4y2Ba在磷酸化。较低的面板,在PKA应用后,当前和高fret占用率的全种群时间依赖性变化。数据表示三个patch和三个FRET实验的均值和标准差(阴影区域)。gydF4y2BaegydF4y2Ba,样品100 s节选smFRET与磷酸化CFTR的痕迹gydF4y2Ba烦恼gydF4y2Ba(左)和在指定ATP浓度下磷酸化野生型CFTR的脂质双分子层中的单通道电生理学(右)。在电生理学痕迹中,向上的偏转对应于开口。底部的痕迹是E1371Q变体的3mm ATP。gydF4y2BafgydF4y2Ba, 3 mM ATP中磷酸化CFTR的开放和二聚的概率。晶须代表最小值和最大值,方框代表39个双分子层和8个FRET实验的第25、50和75个百分位。用双尾学生检验统计学显著性gydF4y2BatgydF4y2Ba以及(* * * *gydF4y2BaPgydF4y2Ba= 2 × 10gydF4y2Ba−18gydF4y2Ba).gydF4y2BaggydF4y2Ba, cftr介导的电流和高fret态占用的ATP剂量响应。用带有EC的Hill方程拟合响应gydF4y2Ba50gydF4y2Ba为53±4µM的开口和ECgydF4y2Ba50gydF4y2Ba为55±8µM的高fret占用。希尔系数固定为1。gydF4y2BahgydF4y2Ba, 3 mM ATP中磷酸化CFTR的开放和二聚事件的驻留时间分布。gydF4y2Ba我gydF4y2Ba,磷酸化CFTR在低和高fret状态之间转换速率的ATP剂量响应gydF4y2Ba烦恼gydF4y2Ba.数据代表三个实验的均值和标准误差。阴影区域表示过渡被时间平均掩盖的区域,从而导致错误的速率估计。gydF4y2Ba
尽管取得了这些进展,但我们对CFTR功能和监管的理解仍然存在重大差距。例如,尽管CFTR的现有结构表明通道打开需要大规模的构象变化,但它们未能解决NBD二聚化和门控机制之间的机制关系。离子渗透如何耦合ATP水解和NBD异构化仍然存在争议。一个模型提出,在每个门控循环中,一轮ATP水解伴随着一个孔打开事件和一个nbd二聚和nbd分离事件gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.替代模型假设nbd通过几个门控循环保持二聚,只有二聚体界面在一致位点部分脱离gydF4y2Ba10gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.CFTR孔隙有严格的建议gydF4y2Ba10gydF4y2Ba,gydF4y2Ba18gydF4y2Ba或概率gydF4y2Ba19gydF4y2Ba在一致位点与核苷酸状态耦合。迄今为止,区分这些模型的尝试还没有定论。此外,在未受影响的个体和囊性纤维化患者中,CFTR活性的限制步骤(因此最有可能对药物调节敏感)仍不清楚。gydF4y2Ba
为了解决这些悬而未决的问题,我们采用了一种综合方法,将atp酶活性的集成测量、单分子荧光共振能量转移(smFRET)成像、电生理学和动力学模拟结合起来,以检查人类CFTR的结构-功能关系。所获得的信息揭示了一种变构门控机制,其中依赖于atp的NBD二聚不足以使孔隙打开。尽管磷酸化的CFTR在生理ATP浓度下主要具有nbd二聚构象,但由ATP周转控制的CFTR下游构象变化是氯离子电导所必需的。疾病相关的改变和药理学增强剂ivacaftor和GLPG1837影响NBD二聚体和离子渗透之间耦合的效率。这些发现确定了催化活性atp结合位点和通道孔之间的变构联系,通道孔作为CFTR生理和药理调节的关键速率限制管道。gydF4y2Ba
CFTR变体smFRET保留原生活性gydF4y2Ba
为了使smFRET成像蛋白的构象状态,我们试图开发一种人类CFTR的变体,可以用马来酰亚胺激活的供体和受体荧光团标记。在取代了18个天然半胱氨酸中的16个后(扩展数据图。gydF4y2Ba1gydF4y2Ba),我们进一步将半胱氨酸引入NBD1 (T388C)和NBD2 (S1435C)中。这个变体,CFTRgydF4y2Ba烦恼gydF4y2Ba用马来酰亚胺激活的自愈合供体(LD555)和受体(LD655)荧光团标记gydF4y2Ba20.gydF4y2Ba生成nbd -二聚体传感器(图;gydF4y2Ba1gydF4y2Ba).两个引入的半胱氨酸的标记是>90%的特异性(扩展数据图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
我们接下来测试CFTR是否gydF4y2Ba烦恼gydF4y2Ba保留了野生型CFTR的功能特性。使用未标记的野生型CFTR和CFTR在切除的内外膜贴片中测量宏观电流gydF4y2Ba烦恼gydF4y2Ba,两者都融合到羧基端GFP标签(扩展数据图。gydF4y2Ba1 b-ggydF4y2Ba).这些数据表明CFTRgydF4y2Ba烦恼gydF4y2Ba进行磷酸化和atp依赖电流,并以与野生型CFTR难以区分的方式保持对增强剂GLPG1837的敏感性(扩展数据图)。gydF4y2Ba1 b, cgydF4y2Ba).在野生型CFTR和CFTR之间,ATP应用时的电流激活和ATP退出时的电流放松的时间过程也没有区别gydF4y2Ba烦恼gydF4y2Ba(扩展数据图。gydF4y2Ba1 dgydF4y2Ba).gydF4y2Ba
我们进一步评估了使用纯化蛋白偶联荧光团对CFTR的影响。洋地黄苷溶解和荧光团标记的CFTRgydF4y2Ba烦恼gydF4y2Ba(扩展数据图。gydF4y2Ba2 a, bgydF4y2Ba)水解ATP的速率几乎与野生型CFTR相同(扩展数据图。gydF4y2Ba1 hgydF4y2Ba).在合成平面脂质双分子层时,荧光团标记CFTRgydF4y2Ba烦恼gydF4y2Ba和野生型CFTR(没有荧光团标签)表现出相似的电流-电压关系、开放概率和对GLPG1837的响应(扩展数据图)。gydF4y2Ba1我gydF4y2Ba).荧光团标记CFTR的单通道电导gydF4y2Ba烦恼gydF4y2Ba略高(扩展数据图;gydF4y2Ba1 i, jgydF4y2Ba),可能是由于C343S取代,一种与孔隙接壤的残留物。基于这些观察,我们得出了CFTR的构象动力学和门控动力学的结论gydF4y2Ba烦恼gydF4y2Ba密切概括野生型CFTR。gydF4y2Ba
NBD二聚体不足以打开孔隙gydF4y2Ba
为了直接研究ATP结合和NBD二聚化之间的关系,我们对洋地黄苷溶解的、c端his标记的CFTR进行了smFRET成像gydF4y2Ba烦恼gydF4y2Ba通过链霉亲和素-生物素-三(NTA-Ni)表面系在钝化微流体室中的分子gydF4y2Ba2 +gydF4y2Ba扩展数据图gydF4y2Ba2摄氏度gydF4y2Ba).成像使用宽视场全内反射荧光显微镜(TIRF)进行,该显微镜配备了科学的互补金属氧化物传感器(sCMOS)检测和止流功能gydF4y2Ba21gydF4y2Ba在10或100毫秒的时间分辨率。单体的雌性生殖道gydF4y2Ba烦恼gydF4y2Ba分子被咪唑从表面近定量释放证明具有高特异性(扩展数据图)。gydF4y2Ba2 dgydF4y2Ba).gydF4y2Ba
基于现有结构,荧光团标记CFTRgydF4y2Ba烦恼gydF4y2Ba预计在nbd分离构象中表现出较低的FRET效率,而在nbd二聚构象中表现出较高的FRET效率(图2)。gydF4y2Ba1gydF4y2Ba).事实上,在缺乏ATP和磷酸化的情况下,CFTR表现出均匀的低fret -效率分布,中心为0.25±0.01(平均±s.d。在六次重复中),并表现出很少,如果有的话,FRET波动(图。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba3gydF4y2Ba).与当前磷酸化和ATP添加的增加一致(图。gydF4y2Ba1 bgydF4y2Ba), smFRET测量还表明,将ATP添加到磷酸化的CFTR中导致了向更高FRET效率的转变(0.49±0.02),其中仅证明了向低FRET状态的短暂偏移(图49±0.02)。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba3 dgydF4y2Ba).在共识位点(E1371Q)上的催化碱基的取代,阻止ATP水解,进一步稳定CFTR在更高的fret -效率构象(图。gydF4y2Ba1 cgydF4y2Ba).在这些观察的基础上,我们将≈0.25和≈0.49的FRET状态分别归于nbd分离和nbd二聚的CFTR构象。gydF4y2Ba
与磷酸化CFTR相比,在去磷酸化通道中添加ATP只引起FRET效率的微小变化,从≈0.25到0.28±0.01(图2)。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba3 bgydF4y2Ba).磷酸化、无atp CFTR的FRET分布也集中在0.28±0.02(图2)。gydF4y2Ba1 cgydF4y2Ba和扩展数据图。gydF4y2Ba3 cgydF4y2Ba).为了探索这一转变的分子基础,我们在3 mM ATP存在下测定了去磷酸化野生型CFTR的冷冻- em结构,分辨率为4.3 Å(扩展数据图)。gydF4y2Ba4gydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).与smFRET数据一致,总体CFTR结构与无atp CFTR结构在很大程度上没有区别。然而,在NBD1和NBD2结合位点上,ATP分子对应的密度都得到了清晰的证明(扩展数据图)。gydF4y2Ba4 dgydF4y2Ba).这些数据表明ATP与脱磷酸化的CFTR结合不会引起任何全局构象变化。FRET效率的微小变化可能是由于影响标记位置和/或动态的局部变化。gydF4y2Ba
与观察到的单个通道的打开概率逐渐增加一致gydF4y2Ba6gydF4y2Ba在饱和ATP (3 mM)的存在下,pka介导的CFTR磷酸化的预稳态测量揭示了个体CFTRgydF4y2Ba烦恼gydF4y2Ba分子并不总是瞬间转变为稳定的nbd二聚态(图。gydF4y2Ba1 dgydF4y2Ba和扩展数据图。gydF4y2Ba3米gydF4y2Ba).相反,通过快速采样NBD分离态和NBD二聚态,实现了稳定的NBD二聚。平行电生理记录显示了匹配的电流激活进程(图。gydF4y2Ba1 dgydF4y2Ba).磷酸酶处理完全可逆NBD二聚(扩展数据图)。gydF4y2Ba3 n, p, rgydF4y2Ba).相比之下,E1371Q取代减慢了NBD分离(扩展数据图。gydF4y2Ba3 o, q rgydF4y2Ba),表明ATP的翻转促进了NBD的分离。这些观察结果表明,逐渐过渡到稳态通道激活可能反映了ATP与单个NBD的随机结合和/或部分磷酸化的R结构域的短暂重新插入,只有当R结构域完全磷酸化且两个NBD同时与ATP结合时,才会向稳定的NBD二聚化转变。gydF4y2Ba
NBD二聚体的ATP剂量反应和完全磷酸化CFTR的电流激活密切相关,两者都产生半最大有效浓度(ECgydF4y2Ba50gydF4y2Ba)的值约为50µM(图;gydF4y2Ba1 e, ggydF4y2Ba和扩展数据图。gydF4y2Ba5 a, b, egydF4y2Ba).这一发现表明,这两个过程都受到同一潜在分子事件的限制。NBD二聚和通道打开概率有很大差异:饱和ATP浓度时,约85%的CFTRgydF4y2Ba烦恼gydF4y2Ba分子处于nbd二聚体构象,但通道打开概率仅为22%(图2)。gydF4y2Ba1 fgydF4y2Ba).因此,我们得出结论,导电和非导电nbd二聚态必须同时存在。gydF4y2Ba
与这一概念一致,观察到的FRET动态不同于证明的门控动态(图。gydF4y2Ba1 e、hgydF4y2Ba).CFTR孔隙打开速率表现出饱和依赖于ATP浓度,而通道关闭速率保持不变gydF4y2Ba16gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.相比之下,nbd二聚和nbd分离速率均随ATP浓度单调变化(图2)。gydF4y2Ba1我gydF4y2Ba).在饱和ATP浓度下,nbd二聚态的停留时间大约是通道打开状态的20倍(图2)。gydF4y2Ba1 hgydF4y2Ba),这表明在nbd二聚体构象中发生了触发通道打开和关闭的FRET-silent过程,并且只需要在二聚体界面上进行微妙的重排即可进行核苷酸交换。这一结论得到了在10 ms和100 ms时间分辨率下进行的类似成像研究的支持。gydF4y2Ba3 egydF4y2Ba).我们得出的结论是,CFTR通过多个门通循环仍然稳定地二聚,或者向部分分离的NBD状态的转变要么是FRET沉默的,要么发生在显著超过我们测量的时间分辨率的时间尺度上(100秒)gydF4y2Ba−1gydF4y2Ba).尽管如此,这两个模型都指出NBD二聚化与通道打开不是严格耦合的。gydF4y2Ba
在细胞ATP与ADP的比值(≈10:1)下,完全磷酸化CFTRgydF4y2Ba烦恼gydF4y2Ba主要占据二聚构象(扩展数据图。gydF4y2Ba3 lgydF4y2Ba),与CFTR在生理环境中主要结合ATP相一致。然而,高ADP浓度能够竞争性地抑制NBD二聚化和通道打开gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba(扩展数据图。gydF4y2Ba3 f-lgydF4y2Ba).gydF4y2Ba
为了验证这些发现的生理相关性,我们对磷酸化CFTR进行了定向smFRET成像研究gydF4y2Ba烦恼gydF4y2Ba重组成蛋白质脂质体(扩展数据图。gydF4y2Ba6gydF4y2Ba).在缺乏ATP的情况下,膜包埋CFTRgydF4y2Ba烦恼gydF4y2Ba分子稳定地占据nbd分离(0.28)FRET状态(扩展数据图。gydF4y2Ba6 bgydF4y2Ba).加入3mm ATP, CFTRgydF4y2Ba烦恼gydF4y2Ba分子过渡到nbd二聚体(0.49)FRET状态(扩展数据图。gydF4y2Ba6摄氏度gydF4y2Ba).atp反应分子的比例降低,可能是由于通道活性的退化或双分子层中的混合取向。然而,响应的分子主要在稳态下占据nbd二聚体构象,只有很少的,短暂的偏移到低FRET效率的状态(扩展数据图)。gydF4y2Ba6 dgydF4y2Ba).CFTR也与预期一致gydF4y2Ba烦恼gydF4y2Ba分子放松到nbd分离状态ATP退出(扩展数据图。gydF4y2Ba6 e, fgydF4y2Ba).这些观察结果证明了洋地黄苷溶化CFTR的物理性质gydF4y2Ba烦恼gydF4y2Ba概括那些存在于脂质双分子层。为了确保最可靠的信号和统计数据,我们使用洋地黄苷溶解的CFTR进行了剩余的smFRET实验gydF4y2Ba烦恼gydF4y2Ba.gydF4y2Ba
atp结合位点不对称地起作用gydF4y2Ba
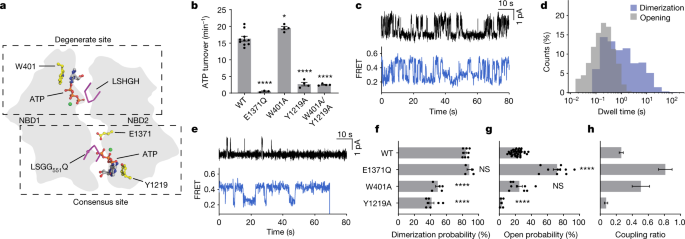
在CFTR中,公认的ATP结合位点每秒水解约0.3到1个ATP分子,而退化位点保留ATP数分钟gydF4y2Ba18gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.我们推断,仅在简并位点的ATP结合就足以使NBD二聚,而在一致位点的ATP结合则是通道打开所必需的。为了验证这一假设,我们试图通过替换芳香族atp堆叠残基W401和Y1219(参考文献)来反褶积两个atp结合位点的个体贡献。gydF4y2Ba26gydF4y2Ba),用丙氨酸分别降低简并位点和一致位点对ATP的亲和力(图。gydF4y2Ba2gydF4y2Ba).退化位点变体W401A水解ATP的速度与野生型CFTR相当,而一致位点变体Y1219A的ATP酶活性仅略微超过背景,这是通过E1371Q变体的类似测量建立的(图)。gydF4y2Ba2 bgydF4y2Ba).双变异体(Y1219A/W401A)的活性与Y1219A变异体的活性难以区分。gydF4y2Ba2 bgydF4y2Ba).这些数据表明Y1219A的取代几乎消除了共识位点上功能相关的atp结合事件。gydF4y2Ba
一个gydF4y2Ba,从质膜上看退化和一致部位的示意图。gydF4y2BabgydF4y2Ba,野生型CFTR及其变体的稳态ATP水解速率。数据表示10(野生型),3 (E1371Q)或4 (W401A, Y1219和W401A/Y1219A)测量的平均值和标准误差。*gydF4y2BaPgydF4y2Ba= 0.014;****gydF4y2BaPgydF4y2Ba= 1.2 × 10gydF4y2Ba−11gydF4y2Ba(e1371q), 2.7 × 10gydF4y2Ba−11gydF4y2Ba(Y1219A)和2.1 × 10gydF4y2Ba−11gydF4y2Ba(W401A / Y1219A)。gydF4y2BacgydF4y2Ba,样品来自CFTR(W401A)变体的单通道电生理学(上)和smFRET(下)。对野生型CFTR和CFTR进行了替换gydF4y2Ba烦恼gydF4y2Ba分别有电生理学和smFRET的背景。在电生理学痕迹中,向上的偏转对应于开口。gydF4y2BadgydF4y2Ba, CFTR开启和二聚事件的驻留时间分布(W401A)。gydF4y2BaegydF4y2Ba,如gydF4y2BacgydF4y2Ba,但是采用CFTR(Y1219A)改型。gydF4y2BafgydF4y2Ba,野生型CFTR的二聚概率gydF4y2Ba烦恼gydF4y2Ba和变异。数据表示8(野生型)、4 (E1371Q)、5 (W401A)和7 (Y1219A)测量值的平均值和标准误差。NS,不显著;****gydF4y2BaPgydF4y2Ba= 8.0 × 10gydF4y2Ba−9gydF4y2Ba(W401A)和4.4 × 10gydF4y2Ba−11gydF4y2Ba(Y1219A)。gydF4y2BaggydF4y2Ba, CFTR变异的开放概率。数据表示39(野生型),10 (E1371Q), 9 (W401A)和5 (Y1291A)双分子层的均值和标准误差。****gydF4y2BaPgydF4y2Ba= 10gydF4y2Ba−15gydF4y2Ba(E1371Q)和4.9 × 10gydF4y2Ba−5gydF4y2Ba(Y1219A)。gydF4y2BahgydF4y2Ba, CFTR变异的耦合比,定义为开放概率除以二聚概率。数据表示均值和标准误差。在所有板中均使用3 mM ATP磷酸化CFTR变体。对于相关组,通过单向方差分析检验与野生型相关的统计学显著性。gydF4y2Ba
W401A和Y1219A变体的构象动力学显著不同,无论是彼此之间,还是与野生型CFTRgydF4y2Ba烦恼gydF4y2Ba(比较图。gydF4y2Ba1 egydF4y2Ba无花果。gydF4y2Ba2 c, egydF4y2Ba).相对于野生型CFTR,能够在共识位点结合和水解ATP的W401A变体在nbd分离态和nbd二聚态之间经历了相对快速的转变,这更类似于电生理记录中测量的孔隙张开动态(图4)。gydF4y2Ba2摄氏度gydF4y2Ba).这主要归因于nbd二聚态停留时间的特定减少(比较图。gydF4y2Ba1 hgydF4y2Ba无花果。gydF4y2Ba二维gydF4y2Ba).相比之下,Y1219A变体主要在简并位点结合ATP,在nbd二聚态和nbd分离态之间缓慢过渡(图2)。gydF4y2Ba2 egydF4y2Ba).然而,在W401A变异中,NBD二聚化和通道打开概率变得更具可比性(图4)。gydF4y2Ba2 c, dgydF4y2Ba), Y1219A变体的单通道测量仅显示出零星的开放事件(图。gydF4y2Ba2 egydF4y2Ba).这些发现表明,当ATP结合和水解在共识位点被取消时,NBD二聚在很大程度上与通道门控不耦合。gydF4y2Ba
在3 mM ATP时,W401A和Y1219A变体的二聚化概率具有可比性,约为野生型水平的50%(图2)。gydF4y2Ba2 fgydF4y2Ba).然而,两种变体的通道打开概率有很大不同(图2)。gydF4y2Ba2 ggydF4y2Ba).虽然W401A变体在这方面的功能与野生型CFTR类似,但Y1219A变体的开放概率几乎为零。这些数据表明ATP在简并位点或一致位点的结合足以使NBD二聚。他们进一步支持向nbd二聚态的转变不一定会导致ATP水解或通道打开,通道打开在很大程度上取决于ATP与共识位点的结合。gydF4y2Ba
通过评估开放概率和NBD二聚化概率之间的“耦合比”,进一步证实了这些结论。gydF4y2Ba2 hgydF4y2Ba),表明耦合效率对ATP对共识位点的占用更为敏感。W401A型的耦合比Y1219A型大6倍。对于E1371Q变体,NBD二聚化和通道开放之间的耦合程度最大,它捕获了水解前的NBD二聚态,两个位点都被ATP占据(图2)。gydF4y2Ba1 egydF4y2Ba).gydF4y2Ba
NBD二聚化先于通道打开gydF4y2Ba
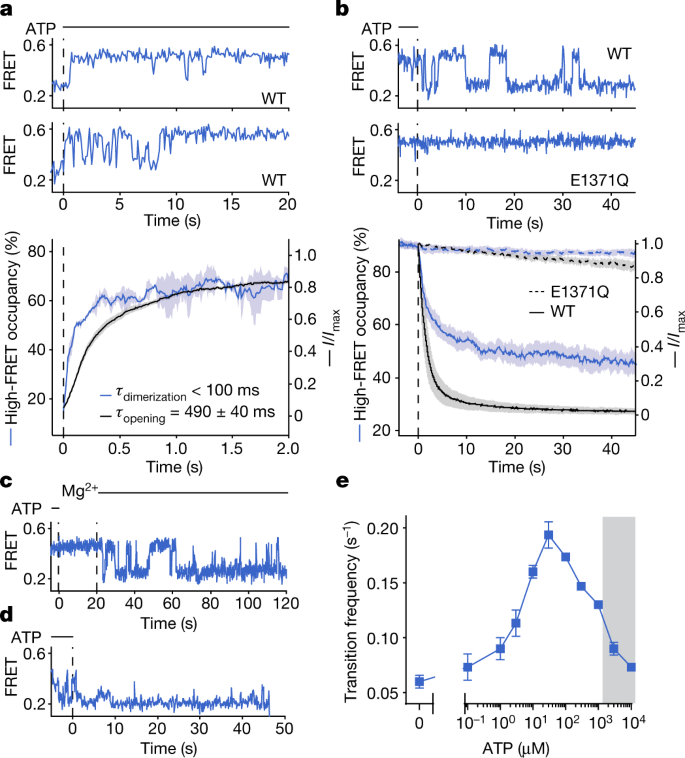
为了检验ATP依赖的NBD二聚体和通道开放之间的时间关系,我们进行了并行实验,在该实验中,监测了响应快速ATP添加的smFRET的预稳态和电生理CFTR反应坐标(图2)。gydF4y2Ba3gydF4y2Ba).在这里,我们分别跟踪了饱和ATP (3 mM)应用于CFTR时NBD二聚化的时间过程和宏观电流增加gydF4y2Ba烦恼gydF4y2Ba在此之前,PKA处理已将其磷酸化,然后将ATP从系统中完全去除。gydF4y2Ba
一个gydF4y2Ba,上面板,具有代表性的smFRET ATP传递痕迹(在虚线处)到磷酸化和无核苷酸的野生型CFTRgydF4y2Ba烦恼gydF4y2Ba.下面板,CFTR高fret占用率的时间依赖变化gydF4y2Ba烦恼gydF4y2BaATP传递后的野生型CFTR电流。数据表示3次FRET实验和42个patch的均值(实线)和标准误差(阴影区域)。个体时间过程拟合为单指数松弛(见扩展数据图)。gydF4y2Ba7 a、bgydF4y2Ba).报告了指数时间常数的平均值和标准误差。gydF4y2BabgydF4y2Ba,上面板,磷酸化野生型CFTR ATP提取的代表性smFRET痕迹(垂直虚线处)gydF4y2Ba烦恼gydF4y2Ba及CFTRgydF4y2Ba烦恼gydF4y2Ba(E1371Q)的变体。下面板,CFTR高fret占用率的时间依赖变化gydF4y2Ba烦恼gydF4y2Ba和ATP从野生型(实线)和E1371Q(虚线)变体中退出后的CFTR电流。数据表示5个FRET实验和41个(野生型)或6个(E1371Q)斑块的均值(线)和标准误差(阴影区)。gydF4y2BacgydF4y2Ba,野生型CFTR中ATP消退的代表性单分子痕迹gydF4y2Ba烦恼gydF4y2Ba.最初毫克gydF4y2Ba2 +gydF4y2Ba不存在,然后重新引入2 mM MggydF4y2Ba2 +gydF4y2Ba.gydF4y2BadgydF4y2Ba, CFTR中ATP退出的代表性单分子痕迹gydF4y2Ba烦恼gydF4y2Ba(W401A)的变体。gydF4y2BaegydF4y2Ba,磷酸化野生型CFTR在低和高fret状态之间转换频率的ATP剂量响应gydF4y2Ba烦恼gydF4y2Ba.数据代表三个实验的均值和标准误差。阴影区域表示过渡被时间平均掩盖的区域,从而导致错误的速率估计。三磷酸腺苷在所有板3毫米处使用。gydF4y2Ba
在这些实验中,个体CFTRgydF4y2Ba烦恼gydF4y2Ba分子要么直接过渡到稳定的nbd二聚态,要么通过快速nbd异构化事件的高度动态间隔(图2)。gydF4y2Ba3gydF4y2Ba),类似于稳定状态下的W401A变体(图。gydF4y2Ba2摄氏度gydF4y2Ba).鉴于R结构域磷酸化在本实验中没有发生变化,我们得出结论,在nbd二聚动力学中观察到的异质性反映了ATP与单个nbd的随机和顺序结合,最终平衡到两个nbd都被ATP占据。gydF4y2Ba
两种反应坐标的激活时间过程的比较进一步揭示了ATP结合通道的开放相对于NBD二聚体延迟。gydF4y2Ba3gydF4y2Ba).通道开通率(gydF4y2BaτgydF4y2Ba开放gydF4y2Ba= 490±40 ms;无花果。gydF4y2Ba3gydF4y2Ba和扩展数据图。gydF4y2Ba7一个gydF4y2Ba)比灌注系统的溶剂交换速率(gydF4y2BaτgydF4y2Ba交换gydF4y2Ba≈150 ms;扩展数据图。gydF4y2Ba7 c, dgydF4y2Ba).相比之下,从FRET测量中拟合的NBD二聚率(gydF4y2BaτgydF4y2Ba二聚gydF4y2Ba≈100 ms)与荧光显微镜下的溶剂交换速率(gydF4y2BaτgydF4y2Ba交换gydF4y2Ba= 115毫秒;扩展数据图。gydF4y2Ba7 b, egydF4y2Ba).因此,观察到的电流激活延迟不能归因于两种实验方法混合速率的差异。因此,我们得出结论,观察到的延迟反映了通道打开之前nbd二聚态中的构象变化,该过程的平均首次通过时间约为400-500 ms。gydF4y2Ba
二聚体在水解循环中持续存在gydF4y2Ba
为了了解孔闭合过程周围的分子事件,我们监测了完全磷酸化的CFTR在突然ATP提取时的构象变化和宏观电流衰减(图2)。gydF4y2Ba3 bgydF4y2Ba和扩展数据图。gydF4y2Ba7 f-lgydF4y2Ba).与之前的研究结果一致gydF4y2Ba15gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,我们的观察表明,ATP的去除导致了依赖于ATP水解的快速电流衰减(扩展数据图。gydF4y2Ba7 f, ggydF4y2Ba).平行FRET实验表明,NBD分离的时间过程是双相的,时间常数分别为1.6 s和20 s(图2)。gydF4y2Ba3 bgydF4y2Ba).这些速率与报告的CFTR电流衰减和配体交换的双指数时间常数相关gydF4y2Ba18gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.这种明显的相关性表明了决定这两种转变的共同的潜在分子机制。gydF4y2Ba
用E1371Q取代抑制ATP水解显著减缓NBD分离,生化方法减少ATP水解或水解后立即发生的构象事件——包括镁的提取,以及氟化铍或氟化铝的添加——也导致NBD分离更慢(图)。gydF4y2Ba3 b, cgydF4y2Ba和扩展数据图。gydF4y2Ba7 i, jgydF4y2Ba).gydF4y2Ba
ATP停用,个体CFTRgydF4y2Ba烦恼gydF4y2Ba分子首先表现出动态的NBD异构化,然后是稳定的NBD分离(图。gydF4y2Ba3 bgydF4y2Ba).这个动态周期类似于Y1219A变体的稳态行为。gydF4y2Ba2 egydF4y2Ba).通过W401A取代破坏ATP在简并位点的结合消除了这一动态周期,这样在ATP提取时直接发生从nbd二聚态到nbd分离态的转变(图4)。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba7 h kgydF4y2Ba).这些观察结果表明,动态周期代表了水解后的状态,在此状态下,一致位点变得空出,退化位点保留ATP。由于ATP重结合在本实验中是不可能的,随后ATP从简并位点解离,然后沉淀稳定的NBD分离(扩展数据图。gydF4y2Ba7 lgydF4y2Ba).ATP从这两个位点的解离可能导致CFTR电流在长时间暴露于无核苷酸溶液后发生可逆的中断gydF4y2Ba29gydF4y2Ba.gydF4y2Ba
在生理ATP浓度(约1-10 mM)下,ATP重结合有望迅速发生在水解后的CFTR分子上,从而在NBD分离之前启动新的催化循环。与这一概念一致,低和高fret状态之间的转换频率表现出钟形依赖于ATP浓度(图。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba5 fgydF4y2Ba).这些结果表明,当ATP浓度大于100µM时,ATP再结合的概率超过NBD完全分离的概率。这一概念,与配体交换实验一致gydF4y2Ba18gydF4y2Ba,表明ATP翻转的重复循环可以发生在表面的nbd二聚构象中,只有在核苷酸交换所需的一致位点发生微妙的变化。因此,在细胞环境中,重复的门控循环预计将持续下去,直到在细胞ATP浓度下NBD的有限分离速率允许去磷酸化的R结构域重新插入,终止CFTR门控。gydF4y2Ba
疾病突变破坏变构耦合gydF4y2Ba
CFTR的广泛改变与囊性纤维化直接相关gydF4y2Ba30.gydF4y2Ba(扩展数据图。gydF4y2Ba8gydF4y2Ba).这些改变影响个体健康的机制大致可分为干扰CFTR表达、折叠或定位或细胞表面通道功能的机制(gydF4y2Bahttps://www.cftr2.org/mutations_historygydF4y2Ba).在这里,我们研究了两种临床证明的影响细胞表面通道门控的变异,G551D和L927P,以了解其缺陷的分子基础。gydF4y2Ba
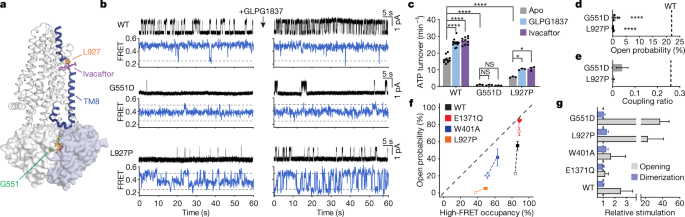
G551残基形成了共识的atp结合位点的一部分,该结合位点协调水解的磷酸盐部分gydF4y2Ba31gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).用天门冬氨酸代替G551几乎取消了通道开放gydF4y2Ba32gydF4y2Ba和ATP水解(图;gydF4y2Ba4罪犯gydF4y2Ba).在磷酸化的CFTR中加入饱和ATP (3 mM)gydF4y2Ba烦恼gydF4y2Ba(G551D)变体,我们观察到FRET效率从nbd分离状态(≈0.25 FRET效率)上升到0.37±0.01。这种中间FRET效率值与野生型CFTR观察到的nbd二聚构象(≈0.49 FRET)明显不同gydF4y2Ba烦恼gydF4y2Ba,表明构象涉及nbd的中间途径(图。gydF4y2Ba4 bgydF4y2Ba和扩展数据图。gydF4y2Ba8 b, dgydF4y2Ba).从这种中间构象中,可以证明到0.49 FRET效率状态的偏移,尽管很少(图2)。gydF4y2Ba4 bgydF4y2Ba).高fret, nbd二聚的CFTR(G551D)构象可能不同于以前通过冷冻电镜观察到的CFTR(E1371Q),其耦合比较低(图2)。gydF4y2Ba4 egydF4y2Ba)和更短的寿命(扩展数据图。gydF4y2Ba8 e, fgydF4y2Ba).与这些数据一致,最近一项低温电镜研究的结果表明,G551D变体采用了介于完全nbd分离构象和nbd二聚构象之间的构象gydF4y2Ba33gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba, CFTR的卡通表示,表示残基G551和L927的位置,以及ivacafter结合位点。通过TM8,电位子结合位点和NBD界面之间的结构链接被标记为蓝色。共识位点ATP显示为棒状。gydF4y2BabgydF4y2Ba,在不存在或不存在10µM GLPG1837的情况下,野生型CFTR和CFTR(G551D)和CFTR(L927P)变体的单通道电生理学(上)和smFRET(下)的样品痕迹。在野生型CFTR和CFTR中进行了替换gydF4y2Ba烦恼gydF4y2Ba电生理学和smFRET实验背景。水平虚线表示低和高FRET状态的平均FRET效率。gydF4y2BacgydF4y2Ba野生型CFTR和CFTR(G551D)和CFTR(L927P)变体的稳态ATP水解速率。在10µM GLPG1837或1µM ivacaftor不存在或存在的情况下进行测量。数据表示10(野生型apo和ivacaftor), 12(野生型GLPG1837)和3 (G551D和L927P所有条件)测量的平均值和标准误差。*gydF4y2BaPgydF4y2Ba= 0.032 (L927P apo vs GLPG1837)和0.017 (L927P apo vs ivacaftor);****gydF4y2BaPgydF4y2Ba= 3 × 10gydF4y2Ba−14gydF4y2Ba(野生型apo与GLPG1837), 4 × 10gydF4y2Ba−15gydF4y2Ba(野生型apo vs ivacaftor), 2 × 10gydF4y2Ba−14gydF4y2Ba(野生型vs G551D)和8.8 × 10gydF4y2Ba−10gydF4y2Ba(野生型与L927P)。gydF4y2BadgydF4y2Ba, G551D和L927P变体的开放概率。数据表示3 (G551D)或6 (L927P)双分子层的平均值和标准误差。虚线表示野生型CFTR的平均打开概率。****gydF4y2BaPgydF4y2Ba= 3.1 × 10gydF4y2Ba−7gydF4y2Ba(G551D)和4.3 × 10gydF4y2Ba−11gydF4y2Ba(L927P)。gydF4y2BaegydF4y2Ba, G551D和L927P变体的耦合比。数据表示均值和标准误差。虚线表示野生型CFTR的耦合比。gydF4y2BafgydF4y2Ba,野生型CFTR, CFTR(E1371Q), CFTR(W401A)和CFTR(L927P)在10 μ M GLPG1837不存在(开放正方形)或存在(填充正方形)时二聚和开放概率的相关性。数据表示39(野生型apo), 9(野生型GLPG1837和W401A apo), 10 (E1371Q apo), 6 (E1371Q GLPG1837和L927P apo), 5 (W401A GLPG1837)和3 (L927P GLPG1837)开放概率测量和8(野生型apo), 4(野生型GLPG1837, E1371Q apo和E1371Q GLP1837), 5 (W401A apo和L927P GLP1837)和3 (W401A GLPG1837和L927P GLPG1837) FRET测量的平均值和标准误差。虚线表示打开和二聚的概率相等。gydF4y2BaggydF4y2Ba, 10µM GLPG1837对开口和二聚概率的相对刺激。数据代表均值和标准差。虚线表示未进行增产。G551D开口处的相对刺激是通过在由内到外切除的补片中测量宏观电流来确定的。在所有板中均使用3 mM ATP磷酸化CFTR变体。对相关组,采用单向方差分析检验统计学意义。gydF4y2Ba
CFTR中的L927残留物位于跨膜铰链区域,该区域在门控过程中介导局部构象变化gydF4y2Ba34gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Ba).因此,提出L927P通过改变nbd二聚CFTR构象中跨膜铰链的灵活性导致囊性纤维化是合理的。与野生型CFTR相比,L927P替代导致atp酶活性降低65%,通道打开概率>降低99%(图2)。gydF4y2Ba4 c, dgydF4y2Ba).它的开放停留时间减少了大约15倍(扩展数据图。gydF4y2Ba8 g hgydF4y2Ba).值得注意的是,L927P取代,尽管距离任何一个atp结合位点50 Å,也不利于nbd二聚化过程。在缺乏ATP的情况下,完全磷酸化的L927P变体表现与野生型CFTR相似gydF4y2Ba烦恼gydF4y2Banbd构成分离(扩展数据图。gydF4y2Ba8 c, dgydF4y2Ba).然而,在ATP引入(3 mM)时,L927P变体采用了一种表现出NBD闭合的中间程度的构象(FRET效率= 0.31±0.01),从这种构象开始,相对频繁地(尽管是短暂的)发生NBD二聚事件(图2)。gydF4y2Ba4 bgydF4y2Ba和扩展数据图。gydF4y2Ba八氟gydF4y2Ba).gydF4y2Ba
对于G551D和L927P变体,FRET转变表现出ATP依赖性,表明野生型ATP结合亲和力(扩展数据图)。gydF4y2Ba8 i (kgydF4y2Ba).它们的功能缺陷是由于ATP缺陷导致紧密NBD二聚体的形成,以及NBD二聚CFTR内变构过程的耦合导致通道开放(图2)。gydF4y2Ba4 egydF4y2Ba).基于G551D和L927P取代的位置,我们假设变构连接通过跨膜螺旋8 (TM8)将构象信息从NBD二聚体界面的一致atp结合位点传递到膜对面的门控区(图5)。gydF4y2Ba4gydF4y2Ba).遥远的G551D和L927P取代都会影响这一变构通信途径,这表明这一链接两端的局部中断都会影响NBD二聚化和通道开放。gydF4y2Ba
电位器促进二聚通道的打开gydF4y2Ba
Ivacaftor是美国食品和药物管理局批准的一种药物,研究化合物GLPG1837(参考文献)。gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba)均在TM8铰链区域内与CFTR结合以促进通道开放gydF4y2Ba37gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Ba).虽然这些化合物对门控动力学的影响已被广泛地描述gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba但是,它们如何改变CFTR的构象景观仍然是难以捉摸的。gydF4y2Ba
与前几次报告的调查结果一致gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,我们的观察表明,这两种增强剂都诱导了通道打开概率的显著增加(图2)。gydF4y2Ba4 b, fgydF4y2Ba和扩展数据图。gydF4y2Ba9gydF4y2Ba).相比之下,它们对所有CFTR变体测试的NBD二聚化的影响要小得多。gydF4y2Ba4 b, fgydF4y2Ba和扩展数据图。gydF4y2Ba9gydF4y2Ba).例如,GLPG1837使G551D变体的开放概率增加了30多倍,而NBD二聚化的变化是边缘的(图2)。gydF4y2Ba4 b, ggydF4y2Ba).这一观察结果,以及最近对CFTR(G551D)变体在ivacaftor存在下的冷冻电镜研究gydF4y2Ba33gydF4y2Ba,表明ivacaftor和GLPG1837都不能促进NBD二聚。同样,对于L927P变体,开放概率的相对刺激大大超过二聚概率的相对刺激(图2)。gydF4y2Ba4 f, ggydF4y2Ba).gydF4y2Ba
在EC下测定GLPG1837促进NBD二聚的效力gydF4y2Ba50gydF4y2Ba对于ATP,大约是60 nM(扩展数据图。gydF4y2Ba9 b, cgydF4y2Ba),与电生理学估计的亲和度相似gydF4y2Ba37gydF4y2Ba.ATP介导二聚化的表观效力也以剂量依赖的方式与GLPG1837增加(扩展数据图。gydF4y2Ba9 dgydF4y2Ba).此外,GLPG1837或ivacaftor减缓了ATP提取过程中NBD的分离速度(扩展数据图。gydF4y2Ba9 egydF4y2Ba),类似于它们对ATP退出后电流松弛速率的影响gydF4y2Ba38gydF4y2Ba.gydF4y2Ba
电位器既缩短了封闭的停留时间,又延长了孔隙的开放停留时间gydF4y2Ba39gydF4y2Ba.在这里,我们表明ivacaftor或GLPG1837可使水解率可测量的野生型CFTR和CFTR(L927P)的稳态ATP水解率提高60-100%。gydF4y2Ba4摄氏度gydF4y2Ba).因此,通过对打开和关闭停留时间的相反影响,这两个增强器通过针对连接nbd和通道门的变构途径,在门控循环中施加净增加的通量。gydF4y2Ba
这些数据得出结论,ivacaftor或GLPG1837的主要作用不是支持从nbd分离构象到nbd二聚构象的转变。相反,当nbd已经二聚时,这些增强剂主要通过促进孔隙打开来发挥作用。换句话说,电位器影响了NBD二聚体和通道开放之间的耦合效率,可能是通过稳定孔开放构型中的跨膜结构域来实现的gydF4y2Ba41gydF4y2Ba.这种效应也体现在无法形成典型NBD二聚体的变体中,如G551D和缺乏整个NBD2的变体(参考文献)。gydF4y2Ba38gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
长期以来,CFTR中NBD二聚是否与孔隙打开严格耦合一直存在争议gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.通过直接比较NBD异构化和通道门控的动力学,我们表明NBD二聚和离子渗透不是严格耦合的,而是通过变构控制机制概率地联系在一起。在生理ATP浓度下,完全磷酸化的CFTR在ATP周转和孔打开的许多循环中保持nbd二聚。nbd二聚CFTR的结构gydF4y2Ba14gydF4y2Ba表明只有在共识位点的微小变化,如破坏R555和T1246之间的氢键(参考文献)。gydF4y2Ba15gydF4y2Ba),足以进行核苷酸交换。值得注意的是,在不同的条件和CFTR变体中,NBD二聚体和孔打开之间的变构关系是正确的,并且对一致位点的核苷酸状态和膜内超过50 Å的电位结合都敏感。gydF4y2Ba
这些发现揭示了一种变构途径,通过TM8和电位器结合位点,将一致的atp酶位点连接到相反膜表面的孔门。从结构上看,我们推测这种远距离信息传递途径最低限度地由TM8和TM9以及它们之间的横向alpha螺旋组成(图2)。gydF4y2Ba4gydF4y2Ba).结构信息沿这一变构途径的传递,物理上将NBD二聚体与孔隙打开联系起来,对CFTR功能具有速率限制。导致囊性纤维化的替代(例如,G551D和L927P)减弱了这一变构途径的强度,而增强剂ivacaftor和GLPG1837则增强了它。观察到G551D和L927P变体在NBD二聚化中也有缺陷,这表明定量挽救该缺陷的调节剂应该与ivacaftor和GLPG1837一起工作。研究的化合物5-硝基-2-(3-苯基丙氨基)苯甲酸酯通过这种机制刺激孔隙打开gydF4y2Ba42gydF4y2Ba.gydF4y2Ba
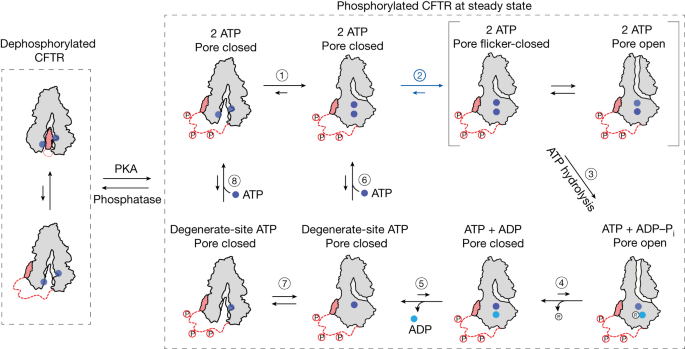
本文提供的数据,结合该领域的大量文献,允许我们提出一个模型,描述在生理ATP浓度下伴随野生型CFTR门控循环的主要事件(图2)。gydF4y2Ba5gydF4y2Ba).去磷酸化的CFTR采用nbd分离的自抑制构象,通过低温电镜观察到gydF4y2Ba13gydF4y2Ba.在R结构域磷酸化后,nbd可以快速二聚,ATP在两个位点结合(图中的步骤1)。gydF4y2Ba5gydF4y2Ba).CFTR内的速率限制构象变化,变构传递来自一致的atp结合位点的信息,穿过脂质双分子层,随后可以打开孔(图中的步骤2)。gydF4y2Ba5gydF4y2Ba)并使ATP水解(图3中的步骤3)。gydF4y2Ba5gydF4y2Ba).在ATP水解之前,孔的打开是瞬态的,闪烁关闭状态是快速采样的gydF4y2Ba43gydF4y2Ba.水解后通道,与ADP和无机磷酸盐结合在一致位点,保持开放,但最终放松到非导电二聚态(图中的步骤4)。gydF4y2Ba5gydF4y2Ba).ADP的解离(图中步骤5)。gydF4y2Ba5gydF4y2Ba)的结果是ATP可以重新结合的动态中间产物(图中的步骤6-8)。gydF4y2Ba5gydF4y2Ba)从而启动另一个门控循环。罕见事件没有在这个模型中描述,因为他们的部分贡献预计在生理ATP浓度下是低的。这些事件包括从退化部位释放ATPgydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,并且ATP通道仅在一个位点开放gydF4y2Ba32gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba或者完全没有核苷酸gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.gydF4y2Ba
通过饱和ATP浓度下完全磷酸化CFTR的NBD动力学和离子传导的稳态动力学模拟,验证了该方案的拓扑结构(扩展数据图)。gydF4y2Ba10gydF4y2Ba而且gydF4y2Ba补充的方法gydF4y2Ba).该拓扑结构中的动力学常数是根据该模型的能力来估计的,该模型可以概括实验观测值,包括NBD二聚体的预稳态速率、通道电流和构象松弛以及来自集成测量的ATP水解速率(扩展数据图。gydF4y2Ba10gydF4y2Ba).利用该拓扑和速率信息,对野生型CFTR和CFTR(E1371Q)门控进行了随机模拟(扩展数据图)。gydF4y2Ba10 b, cgydF4y2Ba)紧密地概括了野生型和E1371Q型门控的关键动力学特征(扩展数据图。gydF4y2Ba10 d - hgydF4y2Ba及补充视频gydF4y2Ba1gydF4y2Ba).然而,该模型的建立揭示了显著的数量差异,值得考虑。首先,我们的模拟预测了一个比实验估计的更大的稳态ATP水解速率。我们推测,这可能反映了简化模型的不足之处,或者在批量测量中存在降低表观周转率的非活性分数。其次,模拟模型没有再现nbd二聚和nbd分离的驻留时间分布的多态性。从我们对改变的简并位点和一致结合位点的分析来看,这些发现表明,这些不同的模式可能反映了CFTR中NBD动态和门通的时期,其中两个atp结合位点中只有一个被占据。这样的考虑意味着对所提出的模型拓扑结构的额外复杂性的要求,将需要通过开发同时检测单分子分辨率的构象状态和功能输出的技术来探索。尽管如此,目前的研究揭示了一个理解CFTR功能、病理和药理学的物理框架,并探索了调节CFTR门控机制的速率限制变构事件的更强激活因子(可能特定于个体的等位基因变异)可以被识别并用于治疗目的的可能性。gydF4y2Ba
方法gydF4y2Ba
蛋白表达、纯化及标记gydF4y2Ba
CFTR的表达如前所述gydF4y2Ba47gydF4y2Ba.在BacMam载体上克隆了具有c端presision蛋白酶可切割GFP标记的人CFTR。对于单分子FRET,介绍了以下取代:C76L、C128S、C225S、C276S、C343S、T388C、C491S、C592M、C647S、C832S、C866S、C1344S、C1355S、C1395S、C1400S、C1410S、S1435C和C1458S。一个deca-His标签c端插入CFTR,在PreScission蛋白酶裂解位点之前,允许表面固定。gydF4y2Ba
重组杆状病毒使用Sf9细胞(Gibco,目录号11496015,批号1670337)在sf-900 SFM培养基(Gibco)中培养,补充5% (v/v)热灭活胎牛血清和1% (v/v)抗生素-抗真菌(Gibco),如上文所述gydF4y2Ba48gydF4y2Ba.HEK293S GnTIgydF4y2Ba−gydF4y2Ba(ATCC CRL-3022, lot number 62430067)悬浮细胞培养于FreeStyle 293培养基(Gibco)中,添加2% (v/v)热灭活胎牛血清和1% (v/v)抗菌素-抗真菌剂(Gibco), 37℃,8% CO振荡gydF4y2Ba2 gydF4y2Ba80%的湿度。Sf9和HEK293S GnTIgydF4y2Ba−gydF4y2Ba细胞分别用Gibco和ATCC进行鉴定,支原体污染阴性。密度为2.5 × 10gydF4y2Ba6gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba,细胞感染10% (v/v) P3杆状病毒。12 h后,向培养液中添加10 mM丁酸钠,温度降至30℃。在进一步48小时后,收集细胞并在液氮中快速冷冻。gydF4y2Ba
为了纯化蛋白质,细胞在含有1.25% (w/v)月桂基麦芽糖新戊二醇(LMNG)、0.25% (w/v)半丁二酸胆甾醇(CHS)、200 mM NaCl、20 mM HEPES (pH 7.2与NaOH)、2 mM MgCl的萃取缓冲液中在4℃下溶解75 mingydF4y2Ba2 gydF4y2Ba、10 μM二硫苏糖醇(DTT)、20% (v/v)甘油、1 mM ATP、1 μg mlgydF4y2Ba−1gydF4y2Ba蛋白酶抑素A, 1 μg mlgydF4y2Ba−1gydF4y2BaLeupeptin, 1 μg mlgydF4y2Ba−1gydF4y2Ba抑肽蛋白,100 μg mlgydF4y2Ba−1gydF4y2Ba大豆胰蛋白酶抑制剂,1 mM苯甲脒,1 mM苯甲基磺酰氟(PMSF)和3µg mlgydF4y2Ba−1gydF4y2BaDNase I.裂解物在75000离心澄清gydF4y2BaggydF4y2Ba在4°C下提取2 × 20分钟,并与与GFP纳米体共轭的nhs激活的Sepharose 4 Fast Flow树脂(GE Healthcare)混合,该树脂已预先平衡在20柱体积的提取缓冲液中。1 h后,将树脂填充到色谱柱中,用含有0.06% (w/v)洋地黄苷、200 mM NaCl、20 mM HEPES (pH 6.8与NaOH)、1 mM ATP和2 mM MgCl的20柱体积洗涤缓冲液洗涤gydF4y2Ba2 gydF4y2Ba,然后用0.35 mg ml在4℃下孵育2 hgydF4y2Ba−1gydF4y2Ba切割蛋白酶用于切割GFP标签。洗脱液通过Glutathione Sepharose 4B树脂(Cytiva)滴滤去除pression蛋白酶,CFTR浓缩至2 μM。gydF4y2Ba
为了用荧光团进行标记,CFTR与9.5 μM马来酰亚胺偶联的LD555和10.5 μM马来酰亚胺偶联的LD655 (Lumidyne Technologies)在4℃下混合10分钟。接下来的步骤是在避光的情况下进行的。加入2 mM DTT淬灭标记反应,用Superose 6 10/300 GL柱(GE Healthcare)在4℃下用凝胶过滤层析纯化标记产物,用0.06% (w/v)地黄皂苷、200 mM NaCl、20 mM HEPES (pH 7.2与NaOH)、1 mM ATP和2 mM MgCl平衡gydF4y2Ba2 gydF4y2Ba.将峰值浓缩至2 μM,并与5 μM生物素- tris- nta - ni混合gydF4y2Ba2 +gydF4y2Ba在4°C下放置30分钟。再经凝胶过滤纯化CFTR-Ni-NTA配合物,浓缩至2 μM,搅拌,在液氮中快速冷冻,-80℃保存。gydF4y2Ba
对于ATP水解测量,调整了纯化方案:提取缓冲液中含有1.25% (w/v) LMNG, 0.25% (w/v) CHS, 200 mM KCl, 20 mM HEPES (pH 8.0与KOH), 2 mM MgClgydF4y2Ba2 gydF4y2Ba、2 mM DTT、20% (v/v)甘油、1 μg mlgydF4y2Ba−1gydF4y2Ba蛋白酶抑素A, 1 μg mlgydF4y2Ba−1gydF4y2BaLeupeptin, 1 μg mlgydF4y2Ba−1gydF4y2Ba抑肽蛋白,100 μg mlgydF4y2Ba−1gydF4y2Ba大豆胰蛋白酶抑制剂,1 mM苯甲脒,1 mM PMSF和3µg mlgydF4y2Ba−1gydF4y2Ba洗涤和凝胶过滤缓冲液含有0.06% (w/v)洋地黄苷,20 mM HEPES (pH 8.0与KOH), 200 mM KCl, 2 mM MgClgydF4y2Ba2 gydF4y2Ba和2毫米DTT。将GFP纳米体树脂的洗脱液浓缩,用PKA (NEB)在25℃下磷酸化1小时,用凝胶过滤层析纯化,然后立即用于水解测定。gydF4y2Ba
为了蛋白脂质体的重建,还对纯化进行了调整:提取缓冲液中含有1.25% (w/v) LMNG, 0.25% (w/v) CHS, 200 mM NaCl, 20 mM HEPES (pH 7.2 with NaOH), 2 mM MgClgydF4y2Ba2 gydF4y2Ba、2 mM DTT、20% (v/v)甘油、1 μg mlgydF4y2Ba−1gydF4y2Ba蛋白酶抑素A, 1 μg mlgydF4y2Ba−1gydF4y2BaLeupeptin, 1 μg mlgydF4y2Ba−1gydF4y2Ba抑肽蛋白,100 μg mlgydF4y2Ba−1gydF4y2Ba大豆胰蛋白酶抑制剂,1 mM苯甲脒,1 mM PMSF和3µg mlgydF4y2Ba−1gydF4y2Ba洗涤和凝胶过滤缓冲液含有0.006% (w/v)糖皂苷元(GDN), 200 mM NaCl, 20 mM HEPES (pH 7.2与NaOH)和2 mM MgClgydF4y2Ba2 gydF4y2Ba.将GFP纳米体树脂的洗脱液浓缩,PKA (NEB)在25℃下磷酸化1 h,凝胶过滤层析纯化,立即重组。gydF4y2Ba
ATP水解测定gydF4y2Ba
用nadh偶联法测定稳态ATP水解活性gydF4y2Ba49gydF4y2Ba.反应缓冲液含有50 mM HEPES (pH 8.0含KOH), 150 mM KCl, 2 mM MgClgydF4y2Ba2 gydF4y2Ba, 2 mM DTT, 0.06% (w/v)洋地黄苷,60µg mlgydF4y2Ba−1gydF4y2Ba丙酮酸激酶(Roche), 32µg mlgydF4y2Ba−1gydF4y2Ba乳酸脱氢酶(Roche), 9 mM磷酸烯醇丙酮酸和150µM NADH,并在实验开始前立即制备。将200 nM浓度的磷酸化CFTR稀释到反应缓冲液中。等分30 μ l的体积分布到康宁384孔黑色/透明平底聚苯乙烯NBS微孔板。样品保存在4°C和光保护下,直到加入3 mM ATP引发反应。荧光耗竭率监测gydF4y2BaλgydF4y2Ba前女友gydF4y2Ba= 340 nm和gydF4y2BaλgydF4y2Ba新兴市场gydF4y2Ba用Infinite M1000酶标仪(Tecan)在28°C下= 445 nm,并通过NADH标准曲线转换为ATP周转。gydF4y2Ba
膜片箝记录gydF4y2Ba
中国仓鼠卵巢细胞(ATCC CCL-61, lot号70014310)在dmemm - f12 (ATCC)中添加10% (v/v)热灭活胎牛血清和1% (v/v) GlutaMAX (Gibco), 37℃。中国仓鼠卵巢细胞经ATCC鉴定。转染前24小时,将细胞镀于35mm细胞培养皿(Falcon)中。根据制造商的协议(Invitrogen),使用Lipofectamine 3000将c - gfp融合的CFTR克隆到BacMam表达载体中转染细胞。转染后12 h,将培养液更换为添加2% (v/v)热灭活胎牛血清和1% (v/v) GlutaMAX的DMEM-F12,在30℃下孵育24 h后记录。gydF4y2Ba
浴液含有145 mM NaCl, 2 mM MgClgydF4y2Ba2 gydF4y2Ba, 5mm氯化钾,1mm氯化钙gydF4y2Ba2 gydF4y2Ba5毫米葡萄糖,5毫米HEPES和20毫米蔗糖(pH 7.4与NaOH)。移液管溶液含有140毫米NMDG, 5毫米氯化钙gydF4y2Ba2 gydF4y2Ba, 2 mM MgClgydF4y2Ba2 gydF4y2Ba和10毫米HEPES (pH 7.4与HCl)。灌注液中含有150 mM NMDG, 2 mM MgClgydF4y2Ba2 gydF4y2Ba, 1mm CaClgydF4y2Ba2 gydF4y2Ba, 10 mM EGTA和8 mM Tris (pH 7.4与HCl)。此处省略镁元素。CFTR通过暴露于PKA (Sigma-Aldrich)和3 mM ATP而激活。gydF4y2Ba
用150 mM NMDG、2 mM MgSO交换灌注液,估算灌注系统缓冲液交换速率gydF4y2Ba4gydF4y2Ba, 1毫米葡萄糖酸钙,10毫米EGTA和8毫米Tris (pH 7.4与HgydF4y2Ba2 gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
移液器从硼硅酸盐玻璃(外径1.5 mm,内径0.86 mm, Sutter)中取出,至1.5 - 2.5 MΩ电阻并火抛光。使用由内而外的贴片配置进行记录,并在贴片处进行局部灌注。膜电位固定在-30 mV。使用Axopatch 200B放大器、Digidata 1550数字化仪和pClamp软件套件(Molecular Devices)在25°C下记录电流。录音以1千赫低通滤波,并以20千赫数字化。所有显示的录音进一步以100 Hz低通滤波。数据用Clampfit、GraphPad Prism和OriginPro进行分析。gydF4y2Ba
Proteoliposome调整gydF4y2Ba
一种含1,2-二油酰的脂质混合物gydF4y2BasngydF4y2Ba-glycero-3-phosphoetanolamine 1-palmitoyl-2-oleyl -gydF4y2BasngydF4y2Ba-甘油-3-磷酸胆碱和1-棕榈酰-2-油酰gydF4y2BasngydF4y2Ba-glycero-3-phospho -gydF4y2BalgydF4y2Ba-丝氨酸以2:1:1 (w/w/w)的比例在含有200 mM NaCl、20 mM HEPES (pH 7.2与NaOH)和2 mM MgCl的缓冲液中超声重悬gydF4y2Ba2 gydF4y2Ba.脂质与GDN混合至最终洗涤剂浓度为2% (w/v),脂质浓度为20 mg mlgydF4y2Ba−1gydF4y2Ba在25°C氩气中放置1小时。纯化后的CFTR与脂质混合物以1:100或1:250 (w/w)的蛋白脂比混合,在4℃氩气下孵育2小时。甲基化β -环糊精以1.2×摩尔比加入GDN反应。在额外的4小时后,加入等量的甲基化β -环糊精。重复这一过程,总共添加了四次。蛋白脂质体在15万离心时收集gydF4y2BaggydF4y2Ba在4°C下悬浮45分钟,再悬浮在含有200 mM NaCl、20 mM HEPES (pH 7.2与NaOH)和2 mM MgCl的缓冲液中gydF4y2Ba2 gydF4y2Ba,在液氮中速冻,并在−80°C保存。gydF4y2Ba
平面脂质双分子层记录gydF4y2Ba
通过涂上1,2-二油酰-合成平面脂质双分子层gydF4y2BasngydF4y2Ba-glycero-3-phosphoetanolamine 1-palmitoyl-2-oleyl -gydF4y2BasngydF4y2Ba-甘油-3-磷酸胆碱和1-棕榈酰-2-油酰gydF4y2BasngydF4y2Ba-glycero-3-phospho -gydF4y2BalgydF4y2Ba-丝氨酸2:1:1 (w/w/w)脂质混合物溶解在癸烷上直径约100微米的塑料透明孔上。含cftr的蛋白质脂质体用PKA (NEB)在25°C下磷酸化1小时,然后与合成的双分子层融合。在含有150 mM NaCl, 2 mM MgCl的对称缓冲液中记录25°C下的电流gydF4y2Ba2 gydF4y2Ba和20 mM HEPES (pH 7.2与NaOH),补充ATP如所示。除非另有说明,电压被夹在150 mV与Axopatch 200B放大器(分子器件)。电流以1 kHz低通滤波,用Digidata 1440A数字化仪在20 kHz进行数字化,并使用pCLAMP软件套件(Molecular Devices)进行记录。所有显示的录音进一步以100 Hz低通滤波。数据用Clampfit、GraphPad Prism和OriginPro进行分析。gydF4y2Ba
单分子荧光成像gydF4y2Ba
成像进行概述在参考文献。gydF4y2Ba50gydF4y2Ba.PEG-和生物素PEG-钝化微流体室用0.8µM链霉亲素(Invitrogen)在含有0.06% (w/v)洋地黄苷、150 mM NaCl、2 mM MgCl的缓冲液中孵育5 mingydF4y2Ba2 gydF4y2Ba20 mM HEPES (pH 7.2与NaOH)。CFTR在固定前被Lambda蛋白磷酸酶(λ, NEB)去磷酸化或被PKA (Sigma-Aldrich)磷酸化。荧光团共轭和生物素-三nta - nigydF4y2Ba2 +gydF4y2Ba将200 pM浓度的结合CFTR在微流体室中固定1分钟,用缓冲液洗涤将未结合的CFTR从通道中清除。成像在含0.06% (w/v)洋地黄苷、150 mM NaCl、2 mM MgCl的脱氧成像缓冲液中进行gydF4y2Ba2 gydF4y2Ba, 20 mM HEPES (pH 7.2与NaOH), 2 mM原儿茶酸和50 nM原儿茶酸-3,4-双加氧酶,以减少光漂白gydF4y2Ba51gydF4y2Ba.MgClgydF4y2Ba2 gydF4y2Ba在注明的地方省略。用300 mM咪唑分离固定化蛋白,在同一天内多次重复使用微流体室。实验在25°C进行。gydF4y2Ba
为了对蛋白脂质体重组的CFTR成像,将含有荧光团标记CFTR的囊泡通过400nm和100nm聚碳酸酯过滤器(Whatman)挤压。然后将囊泡与1 μ M生物素- tris- nta - ni孵育gydF4y2Ba2 +gydF4y2Ba.biotin-tris-NTA-Ni过剩gydF4y2Ba2 +gydF4y2Ba是通过15万的超离心将囊泡制成颗粒去除的吗gydF4y2BaggydF4y2Ba45分钟,去除上清液,在含有150 mM NaCl, 2 mM MgCl的缓冲液中重悬gydF4y2Ba2 gydF4y2Ba20 mM HEPES (pH 7.2与NaOH)。这个过程重复了两次。囊泡在微流体室中固定5分钟,用缓冲液清洗通道中未结合的囊泡。成像在含150 mM NaCl, 2 mM MgCl的脱氧成像缓冲液中进行gydF4y2Ba2 gydF4y2Ba, 20 mM HEPES (pH 7.2与NaOH), 2 mM原儿茶酸和50 nM原儿茶酸-3,4-双加氧酶。gydF4y2Ba
单分子成像使用定制的宽视场、棱镜式全内反射荧光显微镜进行。LD555荧光团被用532纳米激光产生的倏逝波激发(Opus,激光量子)。从LD555和LD655发射的荧光用1.27 NA 60×水浸式objective (Nikon)收集,用T635lpxr二向色(Chroma)进行光谱分离,并在两个Fusion sCMOS相机(Hamamatsu)上成像,整合周期为10或100 ms。gydF4y2Ba
单分子FRET数据分析gydF4y2Ba
在MATLAB中使用SPARTAN分析软件对单分子荧光数据进行分析gydF4y2Ba21gydF4y2Ba.FRET轨迹由发射的供体和受体荧光强度计算(gydF4y2Ba我gydF4y2BaDgydF4y2Ba而且gydF4y2Ba我gydF4y2Ba一个gydF4y2Ba,分别为gydF4y2BaEgydF4y2Ba烦恼gydF4y2Ba=gydF4y2Ba我gydF4y2Ba一个gydF4y2Ba/(gydF4y2Ba我gydF4y2Ba一个gydF4y2Ba+gydF4y2Ba我gydF4y2BaDgydF4y2Ba).根据以下标准选择FRET轨迹进行进一步分析:单步供体光漂白;信噪比>8;眨眼事件少于4次;和FRET效率高于基线至少50帧。此外,表现出FRET值高于0.8的单分子痕迹被排除在分析之外。该亚群对磷酸化和核苷酸不敏感,可能反映了分子变性。对于动力学分析,痕迹也被手动整理以去除明显的光物理人工制品。利用分段法对FRET轨迹进行了理想化gydF4y2Bak -gydF4y2Ba意味着算法gydF4y2Ba52gydF4y2Ba模型包含两种非零FRET状态,FRET值分别为0.25±0.1和0.48±0.1。使用GraphPad Prism和OriginPro对数据进行进一步分析。gydF4y2Ba
电子显微镜数据采集与处理gydF4y2Ba
直接从凝胶过滤中脱磷的野生型CFTR浓缩至5.5 mg mlgydF4y2Ba−1gydF4y2Ba.在应用于Quantifoil R1.2/1.3 400目金网格之前,立即向样品中加入3mm ATP和3mm氟化fos -胆碱-8,然后使用Vitrobot Mark IV (FEI)进行玻璃化。gydF4y2Ba
Cryo-EM图像使用300kev Titan Krios透射电子显微镜收集,并配备了使用SerialEM的Gatan K2 Summit探测器gydF4y2Ba53gydF4y2Ba.共在超分辨率模式下收集了3,501张显微照片,标称离焦范围为0.8-2.5µm。显微照片的物理像素大小为1.03 Å (0.515 Å超分辨率像素大小)。显微照片在10秒曝光(每帧0.2秒)下记录,剂量率为每像素每秒8个电子。gydF4y2Ba
图像堆栈的增益归一化,由2,并校正光束诱导的标本运动与MotionCor2(参考。gydF4y2Ba54gydF4y2Ba).对比度传递函数估计采用GCTF进行gydF4y2Ba55gydF4y2Ba.图像的估计分辨率低于4.5 Å被删除。粒子最初是用RELION中的拉普拉斯-高斯实现来挑选的gydF4y2Ba56gydF4y2Ba.然后从该粒子集中选择二维类用于基于模板的粒子选取。采集的710,322个颗粒经过几轮二维和三维分类清洗。总共有157,629个粒子被包含在最终的细化地图中。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
低温电子显微镜图已存入电子显微镜数据库,登录代码gydF4y2Baemd - 29637gydF4y2Ba.相应的原子模型已按登录代码存入蛋白质数据库gydF4y2Ba8 fzqgydF4y2Ba.支持本研究结果的数据可根据合理要求从作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
囊性纤维化遗传学:从分子认识到临床应用。gydF4y2BaNat. Rev. Genet。gydF4y2Ba16gydF4y2Ba, 45-56(2015)。gydF4y2Ba
赖尔登,J. R.等。囊性纤维化基因鉴定:互补DNA的克隆和鉴定。gydF4y2Ba科学gydF4y2Ba245gydF4y2Ba, 1066-1073(1989)。gydF4y2Ba
罗门斯,J. M.等。囊性纤维化基因鉴定:染色体行走和跳跃。gydF4y2Ba科学gydF4y2Ba245gydF4y2Ba, 1059-1065(1989)。gydF4y2Ba
Gadsby, D, Vergani, P. & Csanády, L. ABC蛋白转变氯通道,其失败导致囊性纤维化。gydF4y2Ba自然gydF4y2Ba440gydF4y2Ba, 477-483(2006)。gydF4y2Ba
Csanády, L., Vergani, P. & Gadsby, d.c. CFTR阴离子通道的结构,门控和调节。gydF4y2Ba杂志。牧师。gydF4y2Ba99gydF4y2Ba, 707-738(2019)。gydF4y2Ba
Hwang, t.c.等。CFTR功能和功能障碍的结构机制。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba150gydF4y2Ba, 539-570(2018)。gydF4y2Ba
程,s.h.等。camp依赖性蛋白激酶对R结构域的磷酸化调控CFTR氯通道。gydF4y2Ba细胞gydF4y2Ba66gydF4y2Ba, 1027-1036(1991)。gydF4y2Ba
Carson, m.r., Travis, s.m. & Welsh, m.j.囊性纤维化跨膜电导调节(CFTR)的两个核苷酸结合结构域在控制通道活性方面具有不同的功能。gydF4y2Ba生物。化学。gydF4y2Ba270gydF4y2Ba, 1711-1717(1995)。gydF4y2Ba
Aleksandrov, L., Aleksandrov, A. A., Chang, X. B. & Riordan, J. R.囊性纤维化跨膜电导调节的第一个核苷酸结合域是一个稳定的核苷酸相互作用的位点,而第二个是一个快速翻转的位点。gydF4y2Ba生物。化学。gydF4y2Ba277gydF4y2Ba, 15419-15425(2002)。gydF4y2Ba
Csanády, L., Vergani, P. & Gadsby, D. C. CFTR的催化循环与Cl-离子孔的门控之间的严格耦合由开放通道爆发持续时间的分布揭示。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 1241-1246(2010)。gydF4y2Ba
Szollosi, A., Vergani, P. & Csanády, L. CFTR的F1296和N1303参与ATP在NBD2结合时诱导的拟合构象变化。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba136gydF4y2Ba, 407-423(2010)。gydF4y2Ba
王,W.等。不依赖于atp的CFTR通道门控和磷酸化的变构调节。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 3888-3893(2010)。gydF4y2Ba
刘峰,张铮,Csanády, L., Gadsby, d.c.,陈杰。人体CFTR离子通道的分子结构。gydF4y2Ba细胞gydF4y2Ba169gydF4y2Ba, 85-95(2017)。gydF4y2Ba
张志,刘飞,陈杰。atp结合磷酸化人CFTR的分子结构。gydF4y2Ba国家科学院学报美国gydF4y2Ba115gydF4y2Ba, 12757-12762(2018)。gydF4y2Ba
Vergani, P. Lockless, s.w., Nairn, a.c. & Gadsby, d.c. CFTR通道通过atp驱动其核苷酸结合域的紧密二聚化打开。gydF4y2Ba自然gydF4y2Ba433gydF4y2Ba, 876-880(2005)。gydF4y2Ba
Vergani, P. Nairn, a.c. & Gadsby, d.c.关于CFTR Cl的mgatp依赖门控机制gydF4y2Ba-gydF4y2Ba频道。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba121gydF4y2Ba, 17-36(2003)。gydF4y2Ba
Chaves, l.a. & Gadsby, d.c.半胱氨酸可达性在门控CFTR通道中沿着二聚体界面探测NBD分离的时间和程度。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba145gydF4y2Ba, 261-283(2015)。gydF4y2Ba
蔡明芳,李明明,黄廷昌。CFTR氯通道中部分NBD二聚体介导的稳定ATP结合。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba135gydF4y2Ba, 399-414(2010)。gydF4y2Ba
Jih, K. Y. & Hwang t.c.非平衡门控CFTR的平衡主题。gydF4y2Ba生理学gydF4y2Ba27gydF4y2Ba, 351-361(2012)。gydF4y2Ba
帕蒂,A. K.等。调节环四氯乙烯的Baird芳香三态能量,以最大限度地提高有机荧光团中的自我修复机制。gydF4y2Ba国家科学院学报美国gydF4y2Ba117gydF4y2Ba, 24305-24315(2020)。gydF4y2Ba
Juette, m.f.等人。毫秒级时间尺度上非平衡分子整体的单分子成像。gydF4y2BaNat方法。gydF4y2Ba13gydF4y2Ba, 341-344(2016)。gydF4y2Ba
冬,M. C.,谢泼德,D. N.,卡森,M. R. &威尔士,M. J. ATP浓度对CFTR Cl的影响gydF4y2Ba-gydF4y2Ba通道:通道调控的动力学分析。gydF4y2BaBiophys。J。gydF4y2Ba66gydF4y2Ba, 1398-1403(1994)。gydF4y2Ba
安德森,M. P. &威尔士,M. J. ATP和ADP对含有突变核苷酸结合域的CFTR氯通道的调控。gydF4y2Ba科学gydF4y2Ba257gydF4y2Ba, 1701-1704(1992)。gydF4y2Ba
ADP通过腺苷酸激酶活性抑制ABC转运蛋白囊性纤维化跨膜电导调节因子的功能。gydF4y2Ba国家科学院学报美国gydF4y2Ba102gydF4y2Ba, 2216-2220(2005)。gydF4y2Ba
Basso, C., Vergani, P., Nairn, a.c . & Gadsby, d.c. .核苷酸与CFTR的NH的延长非水解相互作用gydF4y2Ba2 gydF4y2Ba-末端核苷酸结合域及其在通道门控中的作用。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba122gydF4y2Ba, 333-348(2003)。gydF4y2Ba
周哲,等。囊性纤维化跨膜电导调节因子(CFTR)的两个ATP结合位点在门控动力学和能量学中起着不同的作用。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba128gydF4y2Ba, 413-422(2006)。gydF4y2Ba
Baukrowitz, T., Hwang, T. C., Nairn, a.c . & Gadsby, d.c. . CFTR Cl通道门控与ATP水解循环的耦合。gydF4y2Ba神经元gydF4y2Ba12gydF4y2Ba, 473-482(1994)。gydF4y2Ba
林文勇,吉,K. Y.,黄廷昌。单氨基酸取代CFTR将ATP转化为抑制配体。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba144gydF4y2Ba, 311-320(2014)。gydF4y2Ba
是的,h。i。等。CFTR的功能稳定性依赖于ATP在其简并结合位点的紧密结合。gydF4y2Baj .杂志。gydF4y2Ba599gydF4y2Ba, 4625-4642(2021)。gydF4y2Ba
Shteinberg, M., Haq, I. J., Polineni, D. & Davies, J. C.囊性纤维化。gydF4y2Ba《柳叶刀》gydF4y2Ba397gydF4y2Ba, 2195-2211(2021)。gydF4y2Ba
里斯,D.,约翰逊,E.和莱温森,O. ABC传送器:改变的力量。gydF4y2Ba细胞生物学。gydF4y2Ba10gydF4y2Ba, 218-227(2009)。gydF4y2Ba
Bompadre, s.g., Sohma, Y., Li, M. & Hwang, t.c. G551D和G1349D是CFTR签名序列中的两个cf相关突变,表现出明显的门控缺陷。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba129gydF4y2Ba, 285-298(2007)。gydF4y2Ba
王c .等。人CFTR的双重药理校正与增强机制。预印在gydF4y2BabioRxivgydF4y2Bahttps://doi.org/10.1101/2022.10.10.510913gydF4y2Ba(2022)。gydF4y2Ba
张志,刘芳,陈杰。CFTR磷酸化与ATP结合的构象变化。gydF4y2Ba细胞gydF4y2Ba170gydF4y2Ba, 483-491(2017)。gydF4y2Ba
Hadida, S.等。发现N-(2,4-二叔丁基-5-羟基苯基)-4-氧-1,4-二氢喹啉-3-羧胺(VX-770, ivacaftor),一种有效的口服生物可利用的CFTR增强剂。gydF4y2Ba医学。化学。gydF4y2Ba57gydF4y2Ba, 9776-9795(2014)。gydF4y2Ba
范德普拉斯,S. E.等。发现N-(3-氨基甲酰-5,5,7,7-四甲基-5,7-二氢- 4h -thieno[2,3-c]吡喃-2-基)- lb -吡唑-5-羧酰胺(GLPG1837),一种新型增强剂,可在很大程度上打开III类突变囊性纤维化跨膜电导调节(CFTR)通道。gydF4y2Ba医学。化学。gydF4y2Ba61gydF4y2Ba, 1425-1435(2018)。gydF4y2Ba
刘,F.等。对CFTR上的一个增强热点进行结构识别。gydF4y2Ba科学gydF4y2Ba364gydF4y2Ba, 1184-1188(2019)。gydF4y2Ba
叶海仁,苏玛,Y.,康拉斯,K. &黄,T. C.一种常用的CFTR电位器机制。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba149gydF4y2Ba, 1105-1118(2017)。gydF4y2Ba
Jih, K. Y. & Hwang, T. C. Vx-770通过促进门控循环和ATP水解循环之间的解耦来增强CFTR功能。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 4404-4409(2013)。gydF4y2Ba
Yu, H.等。多重CFTR通道的门控突变。gydF4y2Baj .囊肿。纤维。gydF4y2Ba11gydF4y2Ba, 237-245(2012)。gydF4y2Ba
Langron, E., Prins, S. & Vergani, P. VX-770对囊性纤维化跨膜电导调节的增强作用涉及水解前O1状态的稳定。gydF4y2BaBr。j .杂志。gydF4y2Ba175gydF4y2Ba, 3990-4002(2018)。gydF4y2Ba
Lin, W. Y., Sohma, Y. & Hwang, T. C.囊性纤维化跨膜电导调节的协同增效作用由两种化学上不同的增效剂,ivacaftor (VX-770)和5-硝基-2-(3-苯基丙氨基)苯甲酸酯门控。gydF4y2Ba摩尔。杂志。gydF4y2Ba90gydF4y2Ba, 275-285(2016)。gydF4y2Ba
Gunderson, K. L. & Kopito, R. R.与通道门控相关的CFTR构象状态:ATP结合和水解的作用。gydF4y2Ba细胞gydF4y2Ba82gydF4y2Ba, 231-239(1995)。gydF4y2Ba
邦帕德,s.g.等人。CFTR门控II:核苷酸结合对开放态稳定性的影响。gydF4y2BaJ. Gen. Physiol。gydF4y2Ba125gydF4y2Ba, 377-394(2005)。gydF4y2Ba
Powe, a.c. Jr, Al-Nakkash, L., Li, M. & Hwang, T. C.囊性纤维化跨膜电导调节器中Walker-A赖氨酸464的突变揭示了其核苷酸结合域之间的功能相互作用。gydF4y2Baj .杂志。gydF4y2Ba539gydF4y2Ba, 333-346(2002)。gydF4y2Ba
Mihályi, C, Töröcsik, B. & Csanády, L.专为CFTR孔开放耦合紧密核苷酸结合域二聚。gydF4y2BaeLifegydF4y2Ba5gydF4y2Ba, e18164(2016)。gydF4y2Ba
张震,陈娟。囊性纤维化跨膜电导调节因子的原子结构。gydF4y2Ba细胞gydF4y2Ba167gydF4y2Ba, 1586-1597(2016)。gydF4y2Ba
戈林等人。用于结构研究的膜蛋白在哺乳动物细胞中的筛选和大规模表达。gydF4y2BaProtoc Nat。gydF4y2Ba9gydF4y2Ba, 2574-2585(2014)。gydF4y2Ba
Scharschmidt, B. F., Keeffe, E. B., Blankenship, N. M. & Ockner, R. K.记录分光光度法测量膜相关Mg-和nak - atp酶活性的验证。gydF4y2Baj .实验室。中国。地中海。gydF4y2Ba93gydF4y2Ba, 790-799(1979)。gydF4y2Ba
迪拉,等人。单分子FRET揭示p型atp酶转运动力学。gydF4y2Ba自然gydF4y2Ba551gydF4y2Ba, 346-351(2017)。gydF4y2Ba
艾特肯,C. E.,马歇尔,R. A. & Puglisi, J. D.在单分子荧光实验中提高染料稳定性的氧清除系统。gydF4y2BaBiophys。J。gydF4y2Ba94gydF4y2Ba, 1826-1835(2008)。gydF4y2Ba
秦峰。基于隐马尔可夫建模的分段k-means方法的单通道电流恢复。gydF4y2BaBiophys。J。gydF4y2Ba86gydF4y2Ba, 1488-1501(2004)。gydF4y2Ba
自动电子显微镜断层扫描使用样本运动的稳健预测。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba152gydF4y2Ba, 36-51(2005)。gydF4y2Ba
郑世强等。MotionCor2:改进冷冻电子显微镜光束诱导运动的各向异性校正。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 331-332(2017)。gydF4y2Ba
张凯。Gctf:实时CTF测定与校正。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba193gydF4y2Ba, 1-12(2016)。gydF4y2Ba
Zivanov, J.等人。在RELION-3中自动高分辨率冷冻- em结构测定的新工具。gydF4y2BaeLifegydF4y2Ba7gydF4y2Ba, e42166(2018)。gydF4y2Ba
菲茨杰拉德,g.a.等。以单分子分辨率定量二次输运。gydF4y2Ba自然gydF4y2Ba575gydF4y2Ba, 528-534(2019)。gydF4y2Ba
确认gydF4y2Ba
我们感谢来自圣裘德儿童研究医院单分子成像中心和洛克菲勒大学伊芙琳·格罗斯·里珀低温电子显微镜资源中心的支持。感谢L. Csanády和I. Chen对稿件的点评。这项工作由HHMI(给J.C.)和美国国立卫生研究院(GM079238给S.B)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
J.L.制备了所有CFTR样品,进行了电生理实验、ATP周转实验和低温电镜实验,并对数据进行了分析。J.L.在D.S.T.的协助下进行了单分子FRET实验并分析了数据,g.f.z.k在所有其他作者的协助下进行了动力学建模和模拟。所有作者都参与了手稿的撰写。S.B.和J.C.监督这个项目。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
s。b。拥有Lumidyne科技的股权。其他作者宣称没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Cédric Govaerts和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1 CFTR的功能特征gydF4y2Ba烦恼gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba.FRET型CFTR的设计。原生取代半胱氨酸、原生保留半胱氨酸和新半胱氨酸的位置分别用黑色、灰色和洋红色球体表示。虚线表示r域结构上未解决的部分。无序c端C1458S的替换没有标注。gydF4y2BabgydF4y2Ba.例子记录显示蛋白激酶A (PKA)激活,atp依赖,和glpg1837刺激电流c端gfp融合野生型和FRET变异CFTR在内外切除斑块。使用3 mM ATP, 300 nM PKA和10µM GLPG1837。gydF4y2BacgydF4y2Ba.相对glpg1837介导的野生型和FRET变异CFTR电流在切除的内-外斑块的刺激。胡须表示最小值和最大值,方框表示25gydF4y2BathgydF4y2Ba, 50gydF4y2BathgydF4y2Ba,和75gydF4y2BathgydF4y2Ba21个(野生型)或6个(FRET变异)斑块的百分位。gydF4y2BadgydF4y2Ba.应用3 mM ATP后,野生型和FRET变体CFTR电流激活的单指数时间常数。数据表示42个(野生型)或11个(FRET变体)补丁的均值和标准误差。gydF4y2BaeggydF4y2Ba.快的指数时间常数(gydF4y2BaegydF4y2Ba)和慢(gydF4y2BafgydF4y2Ba)的电流弛豫分量,以及缓慢分量(gydF4y2BaggydF4y2Ba),用于野生型和FRET型CFTR。数据表示38个(野生型)或3个(FRET变体)补丁的均值和标准误差。gydF4y2BahgydF4y2Ba.从大量实验中测定野生型和荧光团标记的FRET变体CFTR的稳态atp酶活性。数据点表示10个(野生型)或3个(FRET变体)测量的平均值和标准误差。gydF4y2Ba我gydF4y2Ba.在合成脂质双分子层中重建的单个野生型(左)和荧光团标记的FRET变体(右)CFTR通道的电压族。膜电位(VgydF4y2Ba米gydF4y2Ba)用生理惯例表示。gydF4y2BajgydF4y2Ba.野生型和荧光团标记的FRET变体CFTR的电流-电压关系。数据点表示3(野生型)或7-18 (FRET变体)通道的均值和标准误差。gydF4y2BakgydF4y2Ba.在合成脂质双分子层中重建的野生型和荧光团标记的FRET变体CFTR的示例记录。CFTR在与双分子层融合前用PKA磷酸化。在添加10µM GLPG1837之前(左)和之后(右)使用3 mM ATP进行记录。gydF4y2BalgydF4y2Ba.在3mm ATP中磷酸化野生型和荧光团标记的FRET变体CFTR的开放概率。数据点表示39(野生型)或17 (FRET变体)通道的均值和标准误差。gydF4y2Ba米gydF4y2Ba.磷酸化野生型和荧光团标记的FRET变体CFTR在3mm ATP中的开放停留时间分布。采用双尾学生t检验(ns:不显著)检验统计学意义。gydF4y2Ba
图2 CFTR的特定部位标记和表面固定化。gydF4y2Ba
一个gydF4y2Ba.新型半胱氨酸荧光团偶联的位点特异性。用马来酰亚胺偶联的LD555和LD655荧光团孵育半胱氨酸不足的CFTR,无论有无T388C/S1435C取代。用SDS-PAGE对产物进行分离。对凝胶进行LD555和LD655荧光成像,然后考马斯染色。标记> 90%特异于两种引入的半胱氨酸。这个实验独立地重复了两次,得到了相似的结果。凝胶源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BabgydF4y2Ba.野生型CFTR和荧光团标记CFTR的凝胶过滤特性gydF4y2Ba烦恼gydF4y2Ba.gydF4y2BacgydF4y2Ba.固定策略示意图。gydF4y2Bad-fgydF4y2Ba.CFTR宽视场荧光图像gydF4y2Ba烦恼gydF4y2Ba无链霉亲和素固定(gydF4y2BadgydF4y2Ba)或涂覆链霉亲和素(gydF4y2BaegydF4y2Ba)表面。(gydF4y2BafgydF4y2BaCFTR)检测gydF4y2Ba烦恼gydF4y2Ba固定在链霉亲和素涂层表面,用0.3 M咪唑清洗。N表示检测到的固定分子的数量。gydF4y2BaggydF4y2Ba.链霉亲和素和his标记依赖固定特异性的定量研究。数据点表示六种固定的均值和标准误差。中固定面的表示gydF4y2BacgydF4y2Ba从ref重新创建。gydF4y2Ba57gydF4y2Ba.gydF4y2Ba
CFTR二聚体的磷酸化和核苷酸依赖性。gydF4y2Ba
安妮gydF4y2Ba.代表性的单分子痕迹显示去磷酸化和无核苷酸CFTR的供体(绿色)和受体(红色)荧光强度(上)和FRET(下)gydF4y2Ba烦恼gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),对CFTR进行脱磷gydF4y2Ba烦恼gydF4y2Ba在3mm ATP存在时(gydF4y2BabgydF4y2Ba),磷酸化和无核苷酸的CFTRgydF4y2Ba烦恼gydF4y2Ba(gydF4y2BacgydF4y2Ba),并磷酸化CFTRgydF4y2Ba烦恼gydF4y2Ba在3mm ATP存在时(gydF4y2Bad egydF4y2Ba).面板gydF4y2Ba模拟gydF4y2Ba收集时间为100 ms。面板gydF4y2BaegydF4y2Ba收集时间为10 ms。gydF4y2BafgydF4y2Ba.磷酸化CFTR高FRET占用剂量依赖性下降的等高线图gydF4y2Ba烦恼gydF4y2Ba在3 mM ATP存在和ADP浓度增加的情况下,由ADP介导。gydF4y2Bag-hgydF4y2Ba.快速分娩后FRET随时间变化的等高线图(gydF4y2BaggydF4y2Ba)或撤回(gydF4y2BahgydF4y2Ba)的10毫米ADP。雌性生殖道gydF4y2Ba烦恼gydF4y2Ba在实验前被磷酸化,整个实验过程中存在3mm ATP。gydF4y2Bai jgydF4y2Ba.例如磷酸化CFTR的FRET动力学变化的单分子痕迹gydF4y2Ba烦恼gydF4y2Ba快速ADP传送后(gydF4y2Ba我gydF4y2Ba)或撤回(gydF4y2BajgydF4y2Ba).整个实验过程中均存在3mm ATP。gydF4y2BakgydF4y2Ba.adp介导的竞争性抑制atp依赖性CFTR电流在一个由内向外切除的斑块的代表性滴定。CFTR在记录前被磷酸化。gydF4y2BalgydF4y2Ba.在3 mM ATP存在下,CFTR介导的电流和磷酸化CFTR的高FRET状态占用的ADP剂量响应。用Hill方程(实线)和一个gydF4y2Ba集成电路gydF4y2Ba50gydF4y2Ba开口为0.57±0.05 mMgydF4y2Ba集成电路gydF4y2Ba50gydF4y2Ba2.3±0.9 mM的高FRET占用。希尔系数固定为1。数据代表7-11个补丁和3个FRET实验的均值和标准误差。gydF4y2Ba米gydF4y2Ba.等高线图显示在CFTR应用300 nM PKA(虚线处)后,FRET随时间而增加gydF4y2Ba烦恼gydF4y2Ba在3mm ATP的存在下。gydF4y2Ban-ogydF4y2Ba.等高线图显示,1µM λ磷酸酶(表示为λ)应用于磷酸化野生型(gydF4y2BangydF4y2Ba)及E1371Q (gydF4y2BaogydF4y2BaCFTR)检测gydF4y2Ba烦恼gydF4y2Ba,在3mm ATP存在时。gydF4y2Bap qgydF4y2Ba.野生型的λ依赖脱磷酸化的单分子痕迹(gydF4y2BapgydF4y2Ba)及E1371Q (gydF4y2Ba问gydF4y2BaCFTR)检测gydF4y2Ba烦恼gydF4y2Ba.gydF4y2BargydF4y2Ba.λ磷酸酶应用于野生型和E1371Q CFTR后FRET高灭虫率的量化gydF4y2Ba烦恼gydF4y2Ba.gydF4y2Ba
图4脱磷酸化和atp结合CFTR的结构表征。gydF4y2Ba
一个gydF4y2Ba.低温电镜工作流程总结。gydF4y2BabgydF4y2Ba.去磷酸化和atp结合的野生型CFTR在4.3 Å分辨率下的冷冻电镜图。gydF4y2BacgydF4y2Ba.去磷酸化和atp结合CFTR (PDBgydF4y2Ba8 fzqgydF4y2Ba)停靠在地图上。gydF4y2BadgydF4y2Ba.一致(左)和简并(右)核苷酸结合位点的ATP密度。gydF4y2Ba
图5 CFTR动态的核苷酸敏感性。gydF4y2Ba
一个gydF4y2Ba.由内而外切除斑块中cftr介导电流的代表性ATP滴定。c端gfp融合野生型CFTR在记录前磷酸化。gydF4y2BabgydF4y2Ba.磷酸化CFTR的FRET分布gydF4y2Ba烦恼gydF4y2Ba以指定的ATP浓度gydF4y2Bac - dgydF4y2Ba.低FRET的停留时间分布(gydF4y2BacgydF4y2Ba)和高FRET (gydF4y2BadgydF4y2Ba)状态的磷酸化CFTRgydF4y2Ba烦恼gydF4y2Ba以指定的ATP浓度gydF4y2BaegydF4y2Ba.磷酸化野生型和E1371Q变异CFTR的等高线图gydF4y2Ba烦恼gydF4y2Ba以指定的ATP浓度gydF4y2BafgydF4y2Ba.在相同条件下的过渡密度图gydF4y2BaegydF4y2Ba.gydF4y2Ba
图6蛋白脂质体重建CFTR的smFRET成像。gydF4y2Ba
一个gydF4y2Ba.蛋白脂质体重组CFTR固定化策略示意图gydF4y2Ba烦恼gydF4y2Ba.雌性生殖道gydF4y2Ba烦恼gydF4y2Ba分子可以在膜中以任意方向重组。gydF4y2Bab-fgydF4y2Ba.示例单分子痕迹显示磷酸化和蛋白脂质体重组CFTR的供体(绿色)和受体(红色)荧光强度(上)和FRET(下)gydF4y2Ba烦恼gydF4y2Ba.在加入ATP (gydF4y2BabgydF4y2Ba),在第一个虚线处(gydF4y2BacgydF4y2Ba),与ATP (gydF4y2BadgydF4y2Ba),在第二虚线(gydF4y2BaegydF4y2Ba),并在ATP提取后处于稳定状态(gydF4y2BafgydF4y2Ba).中固定面的表示gydF4y2Ba一个gydF4y2Ba从ref重新创建。gydF4y2Ba57gydF4y2Ba.gydF4y2Ba
图7 CFTR孔隙开闭与NBD构象的关系。gydF4y2Ba
一个gydF4y2Ba.对ATP应用的电流响应记录示例。将3mm ATP快速应用于一个由内而外切除的贴片,贴片中含有c端gfp融合的野生型CFTR(虚线处)。记录前进行pka磷酸化。时间过程用单指数函数拟合(红线)。gydF4y2BabgydF4y2Ba.应用ATP时FRET响应的测量实例。3 mM ATP快速应用于pka磷酸化的CFTRgydF4y2Ba烦恼gydF4y2Ba(在虚线处)。时间过程用单指数函数拟合(红线)。gydF4y2BacgydF4y2Ba.代表性的由内至外切除的斑块显示局部灌注时溶质交换速率。CFTR在记录前被磷酸化。应用3 mM ATP诱导CFTR电流。氯化物能斯特电位通过从含氯灌注溶液(蓝条)到含硫酸盐灌注溶液(红条)的交换来切换。gydF4y2BadgydF4y2Ba.溶质交换后电流弛豫率。数据表示7个补丁的平均值(黑色实线)和标准误差(灰色阴影区域)。时间过程符合单指数函数(红线)。gydF4y2BaegydF4y2Ba.将dna共轭的Cy2荧光团注射到成像室后(在虚线处)荧光强度的弛豫率。实验时间过程(黑点)用单指数函数(红线)拟合。gydF4y2Baf-hgydF4y2Ba.由内向外切除斑块中ATP退出后CFTR电流松弛的代表性记录:野生型CFTR ATP退出,BeFgydF4y2Ba3.gydF4y2Ba−gydF4y2Ba-捕获野生型CFTR和E1371Q CFTR (gydF4y2BafgydF4y2Ba);在缺乏Mg的情况下,野生型CFTR的ATP减少gydF4y2Ba2 +gydF4y2Ba,再施MggydF4y2Ba2 +gydF4y2Ba(gydF4y2BaggydF4y2Ba);从W401A CFTR提取ATP (gydF4y2BahgydF4y2Ba).2 mM MggydF4y2Ba2 +gydF4y2Ba在整个录音中都存在gydF4y2BafgydF4y2Ba而且gydF4y2BahgydF4y2Ba.3毫米ATP, 0.5毫米BeFgydF4y2Ba3.gydF4y2Ba−gydF4y2Ba, 2 mM MggydF4y2Ba2 +gydF4y2Ba,并将10mm EDTA灌注到指定的补丁上。在显示记录之前,应用300 nM PKA和3 mM ATP激活CFTR。gydF4y2Bai (kgydF4y2Ba.从磷酸化的CFTR中提取atp后FRET反应的等高线图gydF4y2Ba烦恼gydF4y2Ba: ATP从野生型CFTR中退出gydF4y2Ba烦恼gydF4y2BaBeF的缺席和存在gydF4y2Ba3.gydF4y2Ba−gydF4y2Ba或阿尔夫gydF4y2Ba4gydF4y2Ba−gydF4y2BaE1371Q CFTRgydF4y2Ba烦恼gydF4y2Ba(gydF4y2Ba我gydF4y2Ba);野生型CFTR的ATP退出gydF4y2Ba烦恼gydF4y2Ba在Mg不存在的情况下gydF4y2Ba2 +gydF4y2Ba复施MggydF4y2Ba2 +gydF4y2Ba(gydF4y2BajgydF4y2Ba);ATP从W401A CFTR中退出gydF4y2Ba烦恼gydF4y2Ba(gydF4y2BakgydF4y2Ba).2 mM MggydF4y2Ba2 +gydF4y2Ba在整个实验过程中gydF4y2Ba我gydF4y2Ba而且gydF4y2BakgydF4y2Ba.3毫米ATP, 0.5毫米BeFgydF4y2Ba3.gydF4y2Ba−gydF4y2Ba, 1 mM AlFgydF4y2Ba4gydF4y2Ba−gydF4y2Ba, 2 mM MggydF4y2Ba2 +gydF4y2Ba和10 mM EDTA存在于指示位置。gydF4y2BalgydF4y2Ba.CFTR孔隙关闭和NBD分离事件示意图。CFTR与两个ATP分子结合,二聚,开放,能够水解。ATP在共识位点水解,随后释放ADP和无机磷酸盐(PgydF4y2Ba我gydF4y2Ba).简并位点仍然被ATP占据,这种中间产物在二聚构象和分离构象之间动态转换。二聚态在一致位点没有ATP的情况下具有较低的打开概率。ATP从简并位点释放导致稳定的NBD分离和通道关闭。ATP以蓝色圆圈表示。gydF4y2Ba
图8囊性纤维化相关变异的特征。gydF4y2Ba
一个gydF4y2Ba.囊性纤维化引起错义突变的位置。突变位点显示为球体。gydF4y2BacgydF4y2Ba.典型的smFRET ATP传递到磷酸化的G551D和从磷酸化的G551D提取的痕迹(gydF4y2BabgydF4y2Ba)及L927P (gydF4y2BacgydF4y2BaCFTR)检测gydF4y2Ba烦恼gydF4y2Ba(垂直虚线处)。水平虚线表示低和高FRET状态的平均FRET效率。ATP浓度为3 mM。gydF4y2BadgydF4y2Ba.等高线图显示,在磷酸化的G551D和L927P变体CFTR应用和退出3 mM ATP(在虚线处)后,FRET随时间变化gydF4y2Ba烦恼gydF4y2Ba.gydF4y2BaegydF4y2Ba.磷酸化野生型、L927P和G551D CFTR的nbd二聚态停留时间分布gydF4y2Ba烦恼gydF4y2Ba在3mm ATP上。数据表示8个(野生型)或3个(G551D和L927P)实验的均值和标准误差。gydF4y2BafgydF4y2Ba.G551D和L927P变体对ATP抑制的FRET反应(虚线处为3 mM ATP变为无核苷酸)。松弛到低FRET拟合单指数函数(实线)。gydF4y2BaggydF4y2Ba.L927P型CFTR的开放停留时间分布。分布与单指数函数拟合(橙色线)。虚线是野生型CFTR开放停留时间分布的单指数拟合。gydF4y2BahgydF4y2Ba.野生型和L927P型CFTR的平均开放停留时间。胡须表示最小值和最大值,方框表示25gydF4y2BathgydF4y2Ba, 50gydF4y2BathgydF4y2Ba,和75gydF4y2BathgydF4y2Ba13(野生型)或13 (L927P)双分子层记录的百分位数。使用双尾学生t检验(****)进行统计学显著性检验gydF4y2BapgydF4y2Ba= 2 × 10gydF4y2Ba−8gydF4y2Ba).gydF4y2Ba我gydF4y2Ba.G551D和L927P变异株平均FRET的ATP剂量响应。用Hill方程拟合响应gydF4y2Ba电子商务gydF4y2Ba50gydF4y2BaG551D为37±7µM, L927P为52±18µM。gydF4y2Baj - kgydF4y2Ba.磷酸化G551D的等高线图(gydF4y2BajgydF4y2Ba)及L927P (gydF4y2BakgydF4y2BaCFTR)检测gydF4y2Ba烦恼gydF4y2Ba以指定的ATP浓度gydF4y2Ba
图9 CFTR NBD动态中依赖于电位器的变化。gydF4y2Ba
一个gydF4y2Ba.在10µM GLPG1837缺失(左)或存在(右)的情况下,野生型、E1371Q、G551D和L927P CFTR变体的单通道电生理学(黑色)和smFRET(蓝色)样品痕迹。底部的痕迹是缺乏ATP的野生型CFTR。其他所有记录均为3 mM ATP。用磷酸化的CFTR进行测量。在电生理学痕迹中,向上的偏转对应于开口。gydF4y2BabgydF4y2Ba.磷酸化野生型CFTR等高线图gydF4y2Ba烦恼gydF4y2Ba用50µM ATP和GLPG1837在指定的浓度。gydF4y2BacgydF4y2Ba.磷酸化野生型CFTR高FRET占用的GLPG1837剂量响应gydF4y2Ba烦恼gydF4y2Ba50 μ M ATP。响应拟合使用希尔方程(实线)与一个gydF4y2Ba电子商务gydF4y2Ba50gydF4y2Ba值为0.06±0.04 μ M。gydF4y2BadgydF4y2Ba.在指定浓度下GLPG1837存在时,高FRET占用的ATP剂量反应。响应用希尔方程(实线)与拟合gydF4y2Ba电子商务gydF4y2Ba50gydF4y2Ba分别为55±8µM(无GLPG1837)、47±8µM (40 nM GLPG1837)、40±9µM (120 nM GLPG1837)和30±5µM(10µM GLPG1837)。gydF4y2BaegydF4y2Ba.从磷酸化的野生型CFTR中提取ATP后,从高FRET状态的种群减少率gydF4y2Ba烦恼gydF4y2Ba在没有电位器的情况下,用10µM GLPG1837,或用100 nM Ivacaftor。数据表示5个(无电位器)或3个(有GLPG1837或Ivacaftor)实验的均值和标准误差(阴影区域)。gydF4y2Ba
图10 CFTR孔隙和NBD动态的随机模拟。gydF4y2Ba
一个gydF4y2Ba.仿真模型的拓扑结构和速率。gydF4y2BacgydF4y2Ba.实验和模拟的野生型smFRET和单通道电生理痕迹(gydF4y2BabgydF4y2Ba)及E1371Q型CFTR (gydF4y2BacgydF4y2Ba).模拟电流轨迹上方的红点表示ATP水解事件。gydF4y2BadgydF4y2Ba.孔隙张开停留时间分布的实验与模拟比较(gydF4y2BacgydF4y2Ba),孔隙封闭(gydF4y2BadgydF4y2Ba), NBD二聚(gydF4y2BaegydF4y2Ba),而NBD分离(gydF4y2BafgydF4y2Ba)各州的野生型CFTR。实验分布以直方图表示,模拟分布以红线表示。在分析中忽略了闪烁关闭,因此打开和关闭停留时间分别反映了打开突发和爆发间停留时间。gydF4y2BahgydF4y2Ba.实验和模拟的稳态ATP水解速率。数据表示10个(野生型)或3个(E1371Q)测量值和1500个(野生型或E1371Q)模拟分子的均值和标准差。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
此文件包含补充方法,表1和表2,图1和参考文献。gydF4y2Ba
补充视频1gydF4y2Ba
CFTR门控的随机模拟。饱和ATP浓度下pka磷酸化野生型CFTR分子的随机模拟。使用扩展数据图10a中概述的拓扑结构和速率。孔隙和NBD动态由模拟smFRET和单通道电生理痕迹表示。红点表示ATP水解事件。第二步,限制毛孔张开的速率,被涂成蓝色。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
列弗林,J.,特里,d.s.,基利克,Z。gydF4y2Baet al。gydF4y2BaCFTR功能,病理和药理在单分子分辨率。gydF4y2Ba自然gydF4y2Ba(2023)。https://doi.org/10.1038/s41586-023-05854-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-023-05854-7gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba