摘要gydF4y2Ba
视觉是由视紫红质家族的光敏G蛋白偶联受体(GPCRs)启动的gydF4y2Ba1gydF4y2Ba.光子被11-原子吸收gydF4y2Ba独联体gydF4y2Ba视紫红质的视网膜发色团,在200飞秒内异构到所有gydF4y2Ba反式gydF4y2Ba构象gydF4y2Ba2gydF4y2Ba,从而启动细胞信号转导过程,最终导致视觉。然而,光激活视网膜诱导视紫红质内部激活事件的分子内机制尚不清楚。这里我们使用室温下的超快时间分辨晶体学gydF4y2Ba3 gydF4y2Ba来确定一个异构体是如何扭曲的gydF4y2Ba反式gydF4y2Ba视网膜储存光子能量,这是启动与G蛋白结合信号状态形成相关的蛋白质构象变化所必需的。在光激活后,扭曲的视网膜在1秒的时间延迟后,与它的结合袋的大量相互作用的一半被拉开,多余的光子能量通过各向异性的蛋白质呼吸运动向细胞外空间的方向释放。值得注意的是,视紫红质蛋白侧链的早期结构运动出现在保守的A类GPCR激活机制的后期阶段。我们的研究揭示了脊椎动物视觉的早期阶段,并指出了激动剂介导的GPCR激活分子机制的基本方面。gydF4y2Ba
主要gydF4y2Ba
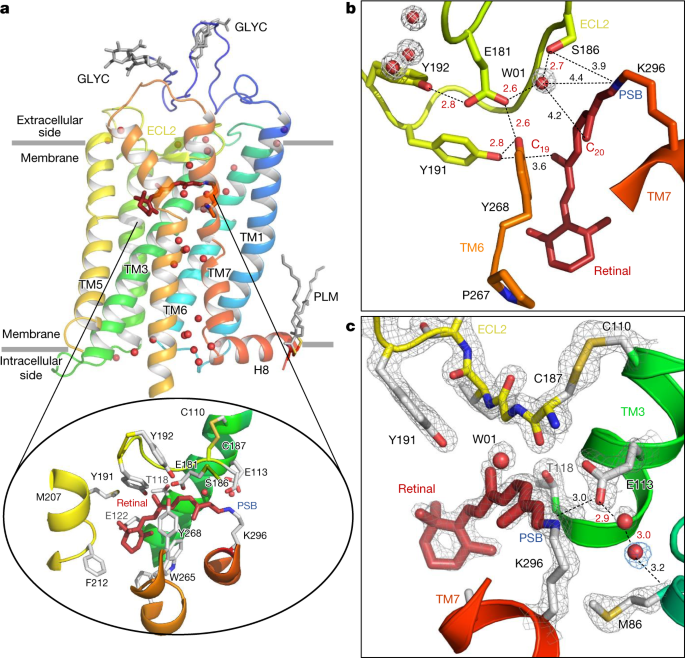
视紫红质是脊椎动物微光视觉的受体,集中在视网膜杆状细胞的盘膜内。视紫红质通过构象变化,激活细胞内G蛋白转导(Gi/o/t家族的一员),将光的吸收转化为生理信号——启动信号级联,导致电脉冲发送到大脑,最终导致视觉感知。视紫红质的结构由7个跨膜α-螺旋和一个11-组成gydF4y2Ba独联体gydF4y2Ba视网膜发色团通过质子化席夫碱(PSB)共价结合到Lys296gydF4y2Ba7.43gydF4y2Ba(含有TM结构域位置的氨基酸的上标值参考Ballesteros-Weinstein方案,在《TM7》的“残留编号”部分解释gydF4y2Ba方法gydF4y2Ba).与许多A类GPCRs相似,这种埋藏的配体位于细胞外侧的TM束内。视网膜还接触细胞外环2 (ECL2),它在发色团上形成一个盖子,并包含一个高度保守的二硫化物桥(Cys110)gydF4y2Ba3.25gydF4y2Ba-Cys187gydF4y2BaECL2gydF4y2Ba)连接到中心螺旋TM3(见参考文献框1)。gydF4y2Ba1gydF4y2Ba).Glu113gydF4y2Ba3.28gydF4y2Ba提供一个带负电荷的反离子gydF4y2Ba4gydF4y2Ba与PSB形成盐桥(图;gydF4y2Ba1得了gydF4y2Ba),从而参与受体静息状态的稳定gydF4y2Ba5gydF4y2Ba.从我们对视觉色素进化的理解gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,我们知道,原来是Glu181gydF4y2BaECL2gydF4y2Ba是唯一能中和希夫碱正电荷的残留物。这个“祖先的对位”gydF4y2Ba8gydF4y2Ba在无脊椎动物中,它仍然是一种复杂的反离子gydF4y2Ba6gydF4y2Ba,仍然通过水介导的氢键网络连接到脊椎动物视紫红质的PSB(图。gydF4y2Ba1 bgydF4y2Ba).第二,主反离子Glu113gydF4y2Ba3.28gydF4y2Ba在进化过程中出现,这两个残基对激活机制都很重要。低温捕获光激活视紫红质的结构gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba、Meta II晚期活性态结构gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,以及丰富的计算gydF4y2Ba14gydF4y2Ba、生化和光谱研究gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba对视紫红质信号转导机制有重要的认识。然而,需要同时提供高空间和时间分辨率的方法来获得从飞秒到毫秒的原子尺度上的激活机制的完整实验推导图像。gydF4y2Ba
一个gydF4y2Ba视紫红质的整体结构,从蓝色(N端)到红色(C端)的残基数呈彩虹状。7 - tm包包含两个gydF4y2BaNgydF4y2Ba-糖基化结构域(GLYC)和棕榈酸基团(PLM)将两亲螺旋H8锚定在膜上(灰色线)。水分子(红色球体)形成了关键的网络gydF4y2Ba1gydF4y2Ba在受体的细胞外(视网膜配体结合袋)和细胞内(G蛋白结合位点)区域之间。11 -gydF4y2Ba独联体gydF4y2Ba视网膜(暗红色)通过PSB与Lys296共价结合。视网膜结合袋进一步由围绕PSB的氨基酸(反离子Glu113,和Met44, Phe91, Thr94, Ala292和Phe293),视网膜脂肪链(Ala117, Thr118, Tyr191, Trp265和Glu181/Ser186通过水W01)和β-ionone环(Gly120, Gly121, Glu122, Phe212, Met207, Phe261和Ala269;为清晰起见,只显示了绑定袋中的选定残留物)。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,连接原始反离子Glu181网络残基的水介导网络中高分辨分子的例子(gydF4y2BabgydF4y2Ba)和TM2(以及Ala117)的对离子Glu113到Met86gydF4y2Ba3.32gydF4y2Ba,未显示)(gydF4y2BacgydF4y2Ba).水分子具有明确的电子密度(灰色和蓝色网格,2gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba电子密度分别为2.2和0.7gydF4y2BaσgydF4y2Ba分别)。gydF4y2Ba
近年来,时间分辨晶体学gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba18gydF4y2Ba在x射线自由电子激光器(XFEL)中已经被用于揭示肌红蛋白的超快结构变化gydF4y2Ba19gydF4y2Ba,光活性黄色蛋白gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,荧光蛋白gydF4y2Ba22gydF4y2Ba,细菌光敏色素gydF4y2Ba23gydF4y2Ba,微生物质子gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba、钠gydF4y2Ba26gydF4y2Ba和氯gydF4y2Ba27gydF4y2Ba泵是细菌的光合反应中心gydF4y2Ba28gydF4y2Ba还有非光感蛋白,外源添加的非天然光笼配体gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba.在时间分辨序列飞秒晶体学(TR-SFX)中,晶体中的蛋白质分子用光学激光脉冲光激活,结构在指定的时间延迟后用XFEL的x射线脉冲探测。由于每个晶体产生一个衍射图案,实验以连续的方式进行:帧是从数万个随机定向的晶体中收集的。TR-SFX方法是光谱方法的补充,揭示了飞秒域原子水平的结构细节,而不直接解决电荷效应、氢键相互作用和电子变化。原子分辨率的代价是不太清楚的照明条件gydF4y2Ba31gydF4y2Ba,这些都是有待讨论的问题gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba32gydF4y2Ba更详细的系统研究正在进行中gydF4y2Ba33gydF4y2Ba.gydF4y2Ba
在这里,我们在室温下使用TR-SFX来跟踪反向激动剂11-的光诱导转换gydF4y2Ba独联体gydF4y2Ba视网膜到激动剂全部gydF4y2Ba反式gydF4y2Ba在脊椎动物视蛋白中。我们的观察揭示了这是如何转化为蛋白质中的早期结构变化的。1秒后,我们观察到一个扭曲的视网膜储存能量,而蛋白质的结构运动辐射作为一个各向异性的传播远离视网膜发色团。视紫红质结构,100 ps后,显示出稍微宽松的构象。gydF4y2Ba
视紫红质的室温结构gydF4y2Ba
在非活性暗态下的室温SFX结构以1.8的分辨率获得Å(扩展数据表gydF4y2Ba1gydF4y2Ba(暗态))来自生长在脂质立方相(LCP)中的微晶体。与从lcp生长的晶体中确定的大多数膜蛋白结构一样,这些晶体显示I型晶格gydF4y2Ba34gydF4y2Ba通过疏水相互作用形成蛋白质二维层的堆叠(扩展数据图。gydF4y2Ba1得了gydF4y2Ba).视紫红质分子的潜在生理相关二聚体gydF4y2Ba35gydF4y2Ba在每个单体的TM1和螺旋8 (H8)段之间形成接触,并以从头到尾的方式组装,生成不对称单元。通过仔细检查衍射数据和得到的电子密度图,发现了平移相关晶体畴的存在。为此,对测量强度进行了修正,在全球范围内提高了地图的质量和可解释性gydF4y2Ba36gydF4y2Ba(gydF4y2Ba方法gydF4y2Ba扩展数据图gydF4y2Ba1 d - igydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).总的来说,SFX结构在非活性暗状态的视紫红质(图。gydF4y2Ba1gydF4y2Ba)与在低温下收集的其他晶体结构非常相似(例如蛋白质数据库(PDB))。gydF4y2Ba1 gzmgydF4y2Ba;均方根偏差= 0.33 Å在CgydF4y2BaαgydF4y2Ba原子)gydF4y2Ba37gydF4y2Ba.与早期在低温条件下解决的结构相比,目前的室温结构揭示了所有先前描述的功能和结构水分子的电子密度。这些包括围绕原始反离子Glu181及其极性酪氨酸笼的水介导的簇。gydF4y2Ba1 bgydF4y2Ba),它们在随后的光激活过程中起作用gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.此外,在连接近端反离子Glu113的席夫碱附近,还分解出一个新的有序水分子gydF4y2Ba3.28gydF4y2Ba对Met86gydF4y2Ba2.53gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba)和Ala117gydF4y2Ba3.32gydF4y2Ba.这种交互在TM包中的TM2-TM3-TM7接口中处于中心位置。gydF4y2Ba
皮秒光引起的视网膜弯曲gydF4y2Ba
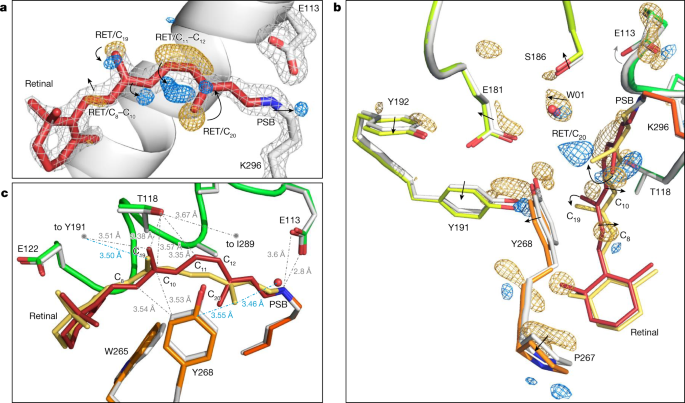
视紫红质的第一亚稳中间体(bathorhodopsin, Batho-Rh)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba40gydF4y2Ba光活化后200秒产生。它被∆填满gydF4y2BatgydF4y2Ba= 1 ps(参考。gydF4y2Ba14gydF4y2Ba,gydF4y2Ba41gydF4y2Ba)并持续数十纳秒gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.为了描述bath - rh的结构,我们收集了瑞士和日本XFELs的TR-SFX数据(扩展数据图)。gydF4y2Ba2gydF4y2Ba)来自lcp生长的视紫红质微晶体,在激光诱导加热较低的情况下被光激活(扩展数据图。gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba方法gydF4y2Ba),在其中我们恢复了高质量的电子密度差图低于最大激活(扩展数据图。gydF4y2Ba3 gydF4y2Ba),使用480 nm波长的飞秒泵浦激光器对∆的光激活进行了三次延迟gydF4y2BatgydF4y2Ba= 1ps, 10ps和100ps。高质量的TR-SFX数据(扩展数据表gydF4y2Ba1gydF4y2Ba)表示为图中的差分傅里叶电子密度图。gydF4y2Ba2 a, bgydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba.对于较短的时间延迟,电子密度的变化以高度各向异性的方式分布,聚集在埋藏的视网膜发色团附近,并通过TM5和TM6螺旋向蛋白质的细胞质侧传播(扩展数据图。gydF4y2Ba5gydF4y2Ba),最低速度为18 Å psgydF4y2Ba−1gydF4y2Ba沿TM6测量(1800米)gydF4y2Ba−1gydF4y2Ba,在水中略高于声速,在核糖核酸酶A晶体中与声速一致gydF4y2Ba44gydF4y2Ba).这种结构各向异性已经完全衰减ΔgydF4y2BatgydF4y2Ba= 100 ps。gydF4y2Ba
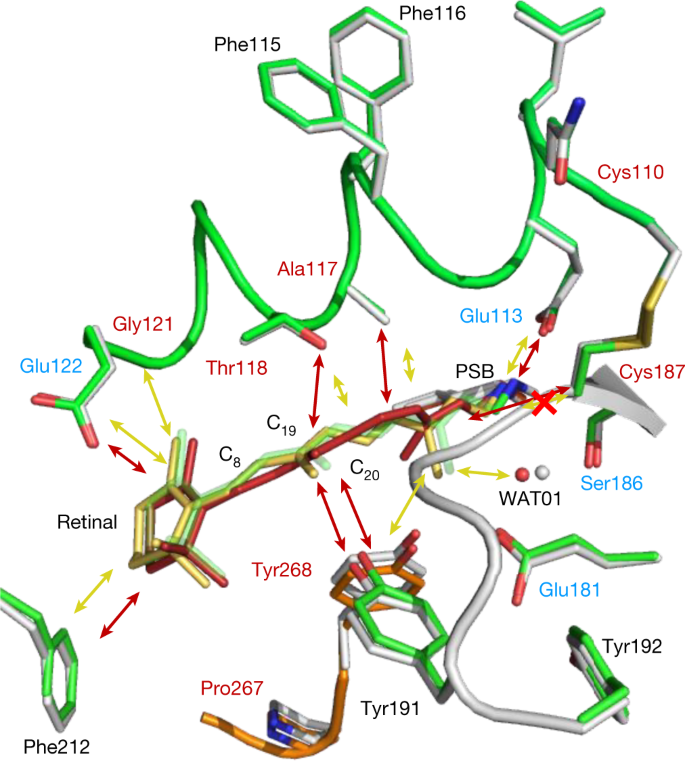
一个gydF4y2Ba,电子密度的变化。视网膜(RET)模型(红色)和轮廓灰色网格(2.7gydF4y2BaσgydF4y2Ba2的gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba电子密度图)与SFX测得的暗态视紫红质相对应。傅立叶电子密度差(gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(光)−gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(深色)轮廓为3.8gydF4y2BaσgydF4y2BaC绕行;gydF4y2Ba11gydF4y2Ba= CgydF4y2Ba12gydF4y2Ba多烯链和CgydF4y2Ba20.gydF4y2Ba甲基在蓝色(正密度)光激活1 ps后出现的特征与金(负密度)中消失的特征相关,表明发色团已经异构化。沿C也观察到负密度gydF4y2Ba8gydF4y2Ba和CgydF4y2Ba10gydF4y2Ba视网膜多烯链。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba视网膜异构化对周围氨基酸残基的影响。1-ps光激活视紫红质模型(黄色为视网膜;视紫红质(橙色和绿色)从推断的地图2gydF4y2BaFgydF4y2BaextgydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba(21%光活化;gydF4y2Ba方法gydF4y2Ba)叠加到暗态模型(红色为视网膜;灰色为视紫红质)。主链CgydF4y2BaɑgydF4y2Ba蛋白质的原子被用于结构叠加。gydF4y2BabgydF4y2Ba,电子密度差图(gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(光)−gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(深色),轮廓为3.4gydF4y2BaσgydF4y2Ba)显示了特定氨基酸(如Tyr268)周围的正负电子密度(蓝色和黄色)gydF4y2Ba6.51gydF4y2Ba捆绑口袋。箭头表示移位或旋转。gydF4y2BacgydF4y2Ba视黄醛多烯链在CgydF4y2Ba11gydF4y2Ba- cgydF4y2Ba13gydF4y2Ba在Tyr268的方向上(视网膜异构键处的π体系(黄色模型)现在相对于暗态的π体系旋转90°gydF4y2Ba48gydF4y2Ba(红色模型)(扩展数据图。gydF4y2Ba6gydF4y2Ba)和沿着CgydF4y2Ba6gydF4y2Ba- cgydF4y2Ba11gydF4y2Ba.从视网膜到视紫红质残基的选定距离以灰色虚线表示暗态,以蓝色虚线表示异构态。gydF4y2Ba
在∆处观察到视网膜多烯链的光诱导结构变化gydF4y2BatgydF4y2Ba= 1 ps作为一个强的负电子密度差特征(最小值为- 6.2)gydF4y2BaσgydF4y2Ba,在那里gydF4y2BaσgydF4y2Ba是单位细胞的均方根电子密度)和互补的正差电子密度特征(最大值为+5.8gydF4y2BaσgydF4y2Ba)(图。gydF4y2Ba2gydF4y2Ba答案CgydF4y2Ba11gydF4y2Ba= CgydF4y2Ba12gydF4y2Ba双键表明这个键已经异构化。这一现象与碳原子附近电子密度的变化有关gydF4y2Ba20.gydF4y2Ba甲基(−6.6gydF4y2BaσgydF4y2Ba和+ 5.6gydF4y2BaσgydF4y2Ba).对这些电子密度变化进行建模,结合晶体学观察的结构细化,推断出光激活中间体的100%占用(光激活水平,请参阅gydF4y2Ba方法gydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba;1-, 10-和100-ps的时间延迟)建立视网膜异构化涉及一个大的(47.7°)顺时针旋转(从PSB上看)CgydF4y2Ba20.gydF4y2Ba甲基(如果采用传统的二面角符号,从β-ionone侧看,则为逆时针)。这种旋转发生在细胞外侧,与近端水分子W01和Tyr268的转移一致gydF4y2Ba6.51gydF4y2BaGlu181笼(图;gydF4y2Ba2 bgydF4y2Ba).C的倾斜gydF4y2Ba20.gydF4y2Ba甲基增加(扩展数据图。gydF4y2Ba6 egydF4y2Ba)变化为51.3°gydF4y2BatgydF4y2Ba= 100 ps。在缺乏时间分辨率的低温捕获bath - rh状态研究中,测量到类似的扭曲为54.9°gydF4y2Ba10gydF4y2Ba(扩展数据图。gydF4y2Ba6 fgydF4y2Ba).我们得出结论,在使用的照明条件下,产生了一个稳定的结构状态。虽然很难获得排除多光子吸收对所观察到的结构状态影响的直接证据,但这表明所观察到的结构变化在定性上是正确的。视网膜的平面包含CgydF4y2Ba19gydF4y2Ba甲基,它位于异构化碳的对面gydF4y2Ba11gydF4y2Ba= CgydF4y2Ba12gydF4y2Ba键,由Thr118固定在静息态gydF4y2Ba3.33gydF4y2Ba(3.36 Å away)gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba和Try191gydF4y2BaECL2gydF4y2Ba.因此,CgydF4y2Ba19gydF4y2Ba甲基只受到最小程度的影响gydF4y2Ba独联体gydF4y2Ba- - - - - - - - -gydF4y2Ba反式gydF4y2Ba异构化(无花果。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba),只向191号火山移动了半埃gydF4y2BaECL2gydF4y2Ba(有36.0°旋转补偿由向后肘部运动的多烯链)和在相反的方向CgydF4y2Ba20.gydF4y2Ba甲基(图。gydF4y2Ba2 b, cgydF4y2Ba).gydF4y2Ba
这些重排在Δ的视网膜分子中gydF4y2BatgydF4y2Ba= 1 ps与光异构化失败的“自行车踏板”机制兼容gydF4y2Ba14gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba其中CgydF4y2Ba19gydF4y2Ba视网膜的甲基在紧密的结合袋中具有特定的残基,可以抵抗这种甲基的更大旋转。故选CgydF4y2Ba9gydF4y2Ba= CgydF4y2Ba10gydF4y2Ba异构化是多烯链上的能量释放,主要影响CgydF4y2Ba8gydF4y2Ba和CgydF4y2Ba10gydF4y2Ba,它们相对于C的方向相反gydF4y2Ba20.gydF4y2Ba甲基(图。gydF4y2Ba2 b, cgydF4y2Ba).CgydF4y2Ba6gydF4y2Ba- cgydF4y2Ba11gydF4y2Ba视黄醛多烯链的一段是弯曲的,使所有的碳以近乎完美的弧度排列。gydF4y2Ba2摄氏度gydF4y2Ba),从而影响捆绑袋内周围的相互作用。gydF4y2Ba
通过在Δ上对实验结构进行量子力学/分子力学(QM/MM)优化计算该态的吸收最大值gydF4y2BatgydF4y2Ba= 1 ps,以及随后在地面与PSB的光学主动第一激发态之间的垂直激发能计算(gydF4y2Ba方法gydF4y2Ba).这产生了相对于暗态32 nm的光谱红移(对于由视网膜PSB, Glu113组成的扩展QM系统而言)gydF4y2Ba3.28gydF4y2Ba, Glu181gydF4y2BaECL2gydF4y2Ba, Tyr191gydF4y2BaECL2gydF4y2Ba, Tyr268gydF4y2Ba6.51gydF4y2Ba, Ser186gydF4y2BaECL2gydF4y2Ba和水W01),与31 nm的实验红移(参考文献)一致。gydF4y2Ba51gydF4y2Ba)用于bath - rh(扩展数据表)gydF4y2Ba2gydF4y2Ba).值得注意的是,在一个简单的QM系统(视网膜PSB)上,使用CASPT2//CASSCF/AMBER方法对牛视紫红质的第一个QM/MM计算产生了约22 nm的红移(参考文献)。gydF4y2Ba48gydF4y2Ba),这与我们在等效QM体系中计算的24 nm值相当。我们对扩展QM系统的计算也表明,扭曲的全-gydF4y2Ba反式gydF4y2Ba视网膜在1ps时储存超过36千卡每摩尔gydF4y2Ba−1gydF4y2Ba与平面11-的能量比较gydF4y2Ba独联体gydF4y2Ba构象(作为比较,480纳米光子的能量为59.6千卡摩尔gydF4y2Ba−1gydF4y2Ba),与实验值32 kcal mol吻合较好gydF4y2Ba−1gydF4y2Ba测量视紫红质到bath - rh的转变gydF4y2Ba52gydF4y2Ba.gydF4y2Ba
视紫红质结合袋1psgydF4y2Ba
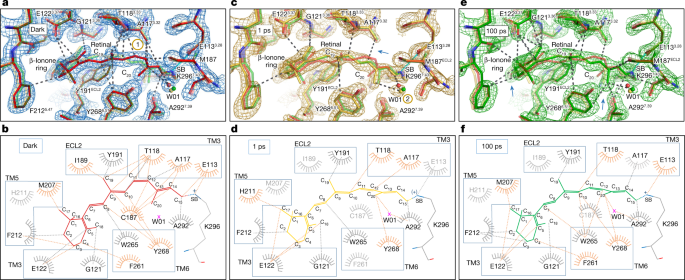
光诱导异构化将视网膜转化为一种激动剂,与视紫红质结合位点的残基发生不同的相互作用。光活化后一皮秒,异构化全部gydF4y2Ba反式gydF4y2Ba视网膜的容量与11-相同gydF4y2Ba独联体gydF4y2Ba静止构象,证实了节省空间运动的假设gydF4y2Ba47gydF4y2Ba,但现在没有几个氢键和范德华相互作用,使暗态结构稳定在一个不活跃的构象(图。gydF4y2Ba3 a, bgydF4y2Ba).共价结合的视网膜弯曲像一个弧,在中间稳定的空间位阻和范德华相互作用之间的CgydF4y2Ba19gydF4y2Ba和CgydF4y2Ba20.gydF4y2Ba视网膜的甲基和两个来自祖先反离子网络的酪氨酸残基,Tyr191gydF4y2BaECL2gydF4y2Ba和Tyr268gydF4y2Ba6.51gydF4y2Ba.C的异构化和旋转gydF4y2Ba20.gydF4y2Ba-methyl-CgydF4y2Ba13gydF4y2Ba- cgydF4y2Ba14gydF4y2Ba平面诱导弯曲CgydF4y2Ba15gydF4y2Ba多烯链对相邻的PSB/Glu113的影响很小gydF4y2Ba3.28gydF4y2Ba在Glu113氢键网络中,除了周围水的顺序W04外(图4)。gydF4y2Ba2摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba6克,hgydF4y2Ba).多烯链与Ala117的相互作用gydF4y2Ba3.32gydF4y2Ba-Thr118gydF4y2Ba3.33gydF4y2Ba是否有两个与TM3的关键视网膜接触在Δ被削弱gydF4y2BatgydF4y2Ba= 1 ps(对比图;gydF4y2Ba3 a, bgydF4y2Ba无花果。gydF4y2Ba3 c, dgydF4y2Ba;扩展数据图。gydF4y2Ba7gydF4y2Ba(上)和补充视频gydF4y2Ba1gydF4y2Ba).另一个与TM3的相互作用被中断,在异构键和Cys187之间gydF4y2BaECL2gydF4y2Ba结构上重要且高度保守的二硫化物桥Cys187-Cys110(参考文献。gydF4y2Ba53gydF4y2Ba),将TM3连接到ECL2(对比图。gydF4y2Ba3 a, bgydF4y2Ba无花果。gydF4y2Ba3 c, dgydF4y2Ba).值得注意的是,在牛视紫红质视网膜周围观察到的光诱导结构变化与从细菌和古生菌中观察到的其他低同源性7 - tm螺旋视网膜结合蛋白在拓扑上有一些相似之处。例如,视网膜和TM3(在原核视蛋白中对应于螺旋C)之间的一些相互作用的减弱或中断也被观察到(扩展数据图。gydF4y2Ba7gydF4y2Ba(下))中的细菌视紫红质gydF4y2Ba24gydF4y2Ba,钠光敏泵KR2gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba氯离子泵gydF4y2Ba纳米gydF4y2Ba人力资源gydF4y2Ba27gydF4y2Ba它们都经历着完全不同的激活机制。因此,尽管它们不同的进化起源和异构化类型(11-gydF4y2Ba独联体gydF4y2Ba所有- - -gydF4y2Ba反式gydF4y2Ba和所有- - -gydF4y2Ba反式gydF4y2Ba13 -gydF4y2Ba独联体gydF4y2Ba),视网膜结合蛋白似乎也需要在进行下一步的激活之前将视网膜从TM中心螺旋中分离出来。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,光激活1 ps(黄色)和100 ps(绿色)后的两个视紫红质模型与视紫红质暗态模型(红色)在PyMol中叠加,残留环境距离以3.7 Å为截止点,使用从视网膜在黑暗中的虚线绘制(gydF4y2Ba一个gydF4y2Ba)及1ps后(gydF4y2BacgydF4y2Ba)及100 ps (gydF4y2BaegydF4y2Ba光活化。席夫碱(SB)和反离子Glu113之间的盐桥用青色标记。黄色圈出的数字1和2分别表示相互作用将减弱和出现的区域(另见蓝色箭头)。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,而PyMol在前面的面板中显示氨基酸的三维结构,LigPlotgydF4y2Ba58gydF4y2Ba表示光激活皮秒延迟期间构象变化中涉及所有氨基酸(橙色)或较少氨基酸(灰色)的平面相互作用图(深色(gydF4y2BabgydF4y2Ba), 1ps (gydF4y2BadgydF4y2Ba)及100 ps (gydF4y2BafgydF4y2Ba))。gydF4y2Ba
随着哺乳动物视紫红质沿着其反应途径进化,一些观察到的变化将变得更加明显,而另一些将恢复原状(图2)。gydF4y2Ba4gydF4y2Ba及扩展数据表gydF4y2Ba3 gydF4y2Ba).由ΔgydF4y2BatgydF4y2Ba= 10和100 ps, β-ionone环和CgydF4y2Ba19gydF4y2Ba- cgydF4y2Ba20.gydF4y2Ba甲基仍然分别与Gly121相互作用gydF4y2Ba3.36gydF4y2Ba-Glu122gydF4y2Ba3.37gydF4y2BaGlu181的酪氨酸gydF4y2BaECL2gydF4y2Ba极笼(图;gydF4y2Ba3 e, fgydF4y2Ba和扩展数据图。gydF4y2Ba7gydF4y2Ba(上)),而例如Tyr268gydF4y2Ba6.51gydF4y2Ba和Pro267gydF4y2Ba6.50gydF4y2BaTM6松弛到初始位置值得注意的是,通过TM6观察到的能量耗散的各向异性特征与暗态视紫红质分子动力学模拟中的固有结构波动是兼容的(扩展数据图)。gydF4y2Ba5 c, dgydF4y2Ba).这种螺旋结构对细胞内G蛋白结合位点相对刚性,但对细胞外结构域明显更灵活,具有关键的Pro267gydF4y2Ba6.50gydF4y2Ba在关节处。gydF4y2Ba
尽管视紫红质被认为是典型的a类GPCR,但GPCRs通过构象选择识别扩散激动剂配体的机制与光激活的GPCRs(如视紫红质)所显示的诱导匹配的极端情况有很大不同gydF4y2Ba54gydF4y2Ba.值得注意的是,构象选择和诱导拟合迅速收敛为一个共同的gpcr激活机制gydF4y2Ba55gydF4y2Ba因此,视网膜异构化的早期阶段可能揭示GPCRs激动的基本决定因素。例如,视网膜结合袋的早期结构变化与Pro215附近的小向外倾斜(约0.5 Å)有关gydF4y2Ba5.50gydF4y2Ba和Pro267gydF4y2Ba6.50gydF4y2Ba,位于TM5和TM6中间附近(图。gydF4y2Ba2 bgydF4y2Ba),并使受体细胞外部分的各向异性运动(扩展数据图。gydF4y2Ba5gydF4y2Ba).这两种脯氨酸残基在A类GPCRs中都是保守的,并且是激动剂诱导激活的关键gydF4y2Ba56gydF4y2Ba.此外,TM3是一个在a类GPCRs TM包的体系结构中具有核心作用的区域gydF4y2Ba57gydF4y2Ba通过形成配体和G蛋白结合袋的一部分。我们的TR-SFX数据显示,即使在激活的早期阶段,逆激动剂(11-gydF4y2Ba独联体gydF4y2Ba视网膜)从TM3剥离(图。gydF4y2Ba3 gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba及补充视频gydF4y2Ba1gydF4y2Ba)同时异构化为激动剂构象(图。gydF4y2Ba3 c, dgydF4y2Ba).TM3中几个受影响的位置(Glu113gydF4y2Ba3.28gydF4y2Ba, Thr118gydF4y2Ba3.33gydF4y2Ba, Gly121gydF4y2Ba3.36gydF4y2Ba和Glu122gydF4y2Ba3.37gydF4y2Ba)对应于A类GPCRs结合位点上参与配体结合的保守残基gydF4y2Ba57gydF4y2Ba,与Gly121结合gydF4y2Ba3.36gydF4y2Ba特别是作为配体识别的共识“摇篮”支架的一部分gydF4y2Ba57gydF4y2Ba.因此,我们使用XFEL的TR-SFX观察揭示了视网膜的光激活构象如何迅速削弱与视紫红质结合袋的氨基酸的许多范德华斯相互作用(图。gydF4y2Ba4gydF4y2Ba),从而将受体的弛豫通路引向其G蛋白结合信号构象。gydF4y2Ba
结论gydF4y2Ba
我们在室温下的非活性暗态视紫红质的高分辨率SFX结构揭示了蛋白质中水介导的氢键网络的完整结构。光激活一皮秒后,视紫红质已达到红移bath - rh中间体。在激活的早期阶段,扭曲的视网膜已经从与结合袋的许多相互作用中解放出来,而结构扰动以瞬态各向异性呼吸运动的形式辐射出去,几乎完全衰减了100 ps。蛋白质中其他微妙和短暂的结构重排出现在GPCR激活的重要区域,与TR-SFX在细菌和古生菌的7 - tm螺旋视网膜结合蛋白光激活过程中观察到的结构重排相似。因此,我们认为蛋白质通过早期的GPCR结构途径分散了最初多余的能量,这将被用于激活。我们的研究揭示了视紫红质通过GPCR激活途径的保守残基发生的超快能量耗散,为研究A类GPCRs大家族的早期激活事件奠定了实验基础。gydF4y2Ba
方法gydF4y2Ba
视网膜中视紫红质的提取和纯化gydF4y2Ba
所有提取纯化步骤均在昏暗的红光条件下进行。市售的深色适应冷冻牛视网膜(W L Lawson公司)根据前面描述的方案被用于分离棒外段(ROS)膜gydF4y2Ba59gydF4y2Ba.简而言之,200个冷冻牛视网膜在ROS缓冲液(10 mM MOPS, 30 mM NaCl, 60 mM KCl, 2 mM MgCl)中稀释gydF4y2Ba2gydF4y2Ba, 1 mM DTT), 40% (w/w)蔗糖和2片cOmplete蛋白酶抑制剂鸡尾酒。用手摇晃混合物4分钟,在4°C, 4000离心gydF4y2BaggydF4y2Ba30分钟。重复这一步骤,将聚集的上清液混合,用不含蔗糖的ROS缓冲液稀释一半,在4°C, 24000离心gydF4y2BaggydF4y2Ba30分钟。将微球重新悬浮在含23.4%蔗糖的ROS缓冲液中,并将其叠放在新制备的梯度上,其中两层ROS缓冲液分别含有34% (w/w)和29% (w/w)蔗糖。使用SW28旋转转子在4°C, 110,000的条件下对ros膜负载的梯度进行离心gydF4y2BaggydF4y2Ba将含视紫红质层(23-29%界面层和29%层)抽吸90分钟,在液氮中快速冷冻。暗态ROS膜的视紫红质浓度,通过记录光照前后的紫外/可见光谱来确定,通常产生200±40 mg视紫红质。如前所述,牛视紫红质可以通过洗涤剂增溶和亲和层析,使用豆蛋白a树脂(ConA, GE医疗生命科学公司)进一步分离gydF4y2Ba60gydF4y2Ba.优化方案:(1)起始视网膜材料加倍;(2)树脂用量按比例放大3倍;(3)为使洗脱剖面更加清晰,洗脱后半段采用逆流进行。将含有180±20mg视紫红质的ROS膜悬浮液在ConA缓冲液(50 mM醋酸钠,150 mM NaCl, 3 mM MgCl)中稀释三次gydF4y2Ba2gydF4y2Ba6小时gydF4y2Ba2gydF4y2BaO, 3mm MnClgydF4y2Ba2gydF4y2Ba4 hgydF4y2Ba2gydF4y2BaO, 3mm CaClgydF4y2Ba2gydF4y2Ba2 hgydF4y2Ba2gydF4y2BaO, 1mm NagydF4y2Ba2gydF4y2Baedta 2 hgydF4y2Ba2gydF4y2BaO, 2 mm2 -巯基乙醇,pH 6),在4°C, 104,000离心gydF4y2BaggydF4y2Ba35分钟。将得到的ROS膜颗粒重悬在含有一片蛋白酶抑制剂的90 ml ConA缓冲液中,并在室温下用十二烷基二甲胺氧化物(LDAO, Sigma-Aldrich)溶解膜至最终浓度为1%。溶解样品在4°C, 118,000离心gydF4y2BaggydF4y2Ba在含有0.1% (w/v) LDAO的ConA缓冲液中进行ConA亲和层析60 min, 0.2 M甲基α-直接洗脱gydF4y2BadgydF4y2Ba-甘露吡喃苷在同一缓冲液中。视紫红质等分2毫克毫升gydF4y2Ba−1gydF4y2Ba在液氮中快速冷冻,并准备用于LCP结晶。gydF4y2Ba
结晶和TR-SFX样品制备gydF4y2Ba
所有结晶和样品制备步骤都在昏暗的红光条件下进行。在LCP结晶前,将快速冷冻的纯化的视紫红质等分液解冻,并交换0.21%的洗涤剂gydF4y2BangydF4y2Ba癸-gydF4y2BaNgydF4y2Ba,gydF4y2BaNgydF4y2Ba二甲胺-gydF4y2BaNgydF4y2Ba-氧化物(DAO, Anatrace)在50 mM醋酸钠,150 mM NaCl, 3 mM MgClgydF4y2Ba2gydF4y2Ba, pH 6.0,使用PD10缓冲液交换柱(Sigma-Aldrich)。洗脱液在18°C, 21000离心gydF4y2BaggydF4y2Ba15分钟,进一步浓缩至至少20-25毫克毫升gydF4y2Ba−1gydF4y2Ba使用浓缩器Ultra 4 MWCO 30在18°C和4000gydF4y2BaggydF4y2Ba.离心18°C, 21000gydF4y2BaggydF4y2Ba蛋白质样品在22°C下与单油酸(1-油酸-rac-甘油,Nu-Check prep)分别以40比60的比例混合15分钟,使用气密Hamilton注射器,直到形成半透明LCP。衍射良好的视紫红质晶体最初是由低分子质量的聚乙二醇屏与各种类型的缓冲,第一次击中检测使用二次谐波成像SONICC(二阶非线性光学成像手性晶体)装置(Formulatrix)。gydF4y2Ba61gydF4y2Ba.为了晶体生长,将20-40 μ l蛋白负载LCP注入含有200-400 μ l沉淀剂(37-39% PEG 600和100 mM Bicine pH 9.0)的Hamilton玻璃注射器中。或者,将80 μ l蛋白负载LCP注射到含有800 μ l沉淀剂的1 ml塑料注射器中。样品用铝包裹,保存于18°C。3天后,通过去除沉淀剂,LCP中尺寸约为15 × 15 × 1.5 μ m的板状晶体可以收集到,并在18°C的黑暗中保持稳定数周。gydF4y2Ba
在x射线自由电子激光光束线上,含有视紫红质晶体的LCP样品必须与三通耦合器混合以确保均匀性gydF4y2Ba62gydF4y2Ba在装入高粘度喷油器之前。为了防止残留沉淀剂污染,负载lcp的晶体样品用PEG 1000 (50% (w/v))滴定,最后与单烯烃1:5混合。gydF4y2Ba
时间分辨泵浦探针系列结晶学gydF4y2Ba
在SACLA的XFELs BL3_EH2端站采集x射线衍射数据gydF4y2Ba63gydF4y2Ba(波束时间2015B8043和2018A8066)和瑞士fel的Alvra端站(波束时间20172060和20200597)。x射线束的能量为9-10 keV,脉冲长度为10 fs (SACLA)和65 fs (SwissFEL),聚焦在1 × 1µm (SACLA)和5 × 5µm (SwissFEL)样品上。在昏暗的红光条件下,在样品位置将飞秒泵浦激光设置为480 nm波长,脉冲能量为9 (SACLA)到5 (SwissFEL) μ J / 100 fs脉冲持续时间。泵浦激光束尺寸为47 ~ 50 μ m FWHM (80 ~ 85 μ m 1/e)gydF4y2Ba2gydF4y2Ba).如果假设理想的高斯光束光学,那么这对应的峰值能量密度为200兆焦耳厘米gydF4y2Ba−2gydF4y2Ba在瑞士fel (Δ)gydF4y2BatgydF4y2Ba= 1 ps),或者平均能量密度为140兆焦耳厘米gydF4y2Ba−2gydF4y2Ba平均激光的焦点FWHM(与参考文献中的表格数据比较。gydF4y2Ba3 gydF4y2Ba;峰值功率密度为2000千兆瓦厘米gydF4y2Ba−2gydF4y2Ba).SACLA研究的相应值(ΔgydF4y2BatgydF4y2Ba= 100 ps)的峰值通量为360 mJ cmgydF4y2Ba−2gydF4y2Ba,平均通量260 mJ cmgydF4y2Ba−2gydF4y2Ba,峰值功率密度为3,600 GW cmgydF4y2Ba−2gydF4y2Ba.实验照明条件的选择,以产生高占用这些观察到的结构状态,随着时间的推移演变。虽然这些条件在光谱实验中被认为是过分的,但如果计算平均通量的乘积(gydF4y2BaFgydF4y2Ba),静息态吸收截面(gydF4y2BaσgydF4y2Ba)除以单个光子的能量(gydF4y2BahgydF4y2BaνgydF4y2Ba,在那里gydF4y2BahgydF4y2Ba普朗克常数和gydF4y2BaνgydF4y2Ba光子的频率)我们恢复gydF4y2BaσgydF4y2BaFgydF4y2Ba/gydF4y2BahgydF4y2BaνgydF4y2Ba= 45的照明条件在瑞士fel和gydF4y2BaσFgydF4y2Ba/gydF4y2BahνgydF4y2Ba在SACLA使用的= 81。尽管这些值可能表明相当大的多光子激发,但时间分辨的x射线溶液散射对视紫红质的研究结果(扩展数据图)。gydF4y2Ba3 gydF4y2Ba)意味着更少的被吸收的光子会导致样品中的加热(参见下面的“时间分辨x射线溶液散射”部分)。此外,使用泵浦激光器的60%的能量(3 μ J每100-fs脉冲,764 GW cmgydF4y2Ba−2gydF4y2Ba)表示在我们的TR-SFX研究中适用的最低能量(扩展数据图。gydF4y2Ba3 gydF4y2Ba)和高于每个视紫红质单光子的光激活状态,这为非线性效应对所观察到的光化学作用的贡献提供了可能性。gydF4y2Ba
在LCP中生长的牛视紫红质晶体用于收集TR-SFX数据,时延分别为1 ps、10 ps (SwissFEL)和100 ps (SACLA)(扩展数据图)。gydF4y2Ba2gydF4y2Ba).采用75 μm喷嘴,在流速为0.033 μl min的恒定条件下,用高粘度喷射器对晶体进行挤压gydF4y2Ba−1gydF4y2Ba(瑞士fel)或2.5 μl mingydF4y2Ba−1gydF4y2Ba(SACLA)gydF4y2Ba64gydF4y2Ba到泵浦探测交点收集数据,每五次泵浦激光被阻塞(数据收集方案为4个光激活,然后1个暗)(SwissFEL)或交错ON/ off激光(在模式1光:1暗(SACLA)),取决于XFELs的重复频率(SwissFEL 25 Hz;SACLA 30 Hz)和泵浦激光器(SwissFEL 25 Hz;SACLA 15 Hz)。作为对照,在泵浦激光器关闭的情况下也收集了真实的暗态数据(所有暗态数据,SFX模式)。gydF4y2Ba
TR-XSS分析gydF4y2Ba
TR-XSS研究使用使用气体动力学虚拟喷嘴(GDVN)液体微射流注入的洗涤剂溶解的视紫红质样品,如前所述,在LCLS进行gydF4y2Ba65gydF4y2Ba.视紫红质溶于gydF4y2BangydF4y2Ba-十二烷基-β-麦芽糖苷浓度为8.4 mg mlgydF4y2Ba−1gydF4y2Ba(0.2毫米)。使用480 nm激光脉冲光激活样品,激光脉冲持续50秒,通过1/e聚焦gydF4y2Ba2gydF4y2Ba直径为100 μm (59 μm FWHM),脉冲功率为6 μJ (110 mJ cm)gydF4y2Ba−2gydF4y2BaFWHM均值;3000千兆瓦厘米gydF4y2Ba−2gydF4y2Ba峰值功率),22 μJ (400 mJ cmgydF4y2Ba−2gydF4y2BaFWHM均值;11200千兆瓦厘米gydF4y2Ba−2gydF4y2Ba峰值功率),45 μJ (830 mJ cmgydF4y2Ba−2gydF4y2BaFWHM均值;22,900 GW cmgydF4y2Ba−2gydF4y2Ba峰值功率为89 μJ (1640 mJ cm)gydF4y2Ba−2gydF4y2BaFWHM均值;45300千兆瓦厘米gydF4y2Ba−2gydF4y2Ba峰值功率)。从这些数据估计激光诱导加热的时间延迟为10ps≤ΔgydF4y2BatgydF4y2Ba≤1 μs(扩展数据图;gydF4y2Ba3 fgydF4y2Ba),但这些数据的稀疏采样和信噪比不允许在该时域内提取多个加热基谱。相比之下,对洗涤剂溶解光合反应中心的TR-XSS研究允许在光激发后的前100 ps内提取两个基本光谱。在该研究中,与第一热基谱相关的振幅在Δ处达到最大值gydF4y2BatgydF4y2Ba= 10 ps,然后过渡到更长的时间尺度的加热基谱,这两个分量的振幅在Δ附近交叉gydF4y2BatgydF4y2Ba= 40 ps(参考。gydF4y2Ba65gydF4y2Ba).我们的视紫红质TR-XSS数据中的主奇异值分解(SVD)成分与温度校准曲线进行了比较(扩展数据图)。gydF4y2Ba3 ggydF4y2Ba)来估计不同光激发通量下激光引起的温度变化,如前所述gydF4y2Ba65gydF4y2Ba.因此传递给样品的加热脉冲总结在扩展数据图中。gydF4y2Ba3 hgydF4y2Ba,并使用负时间点作为对照(绘制为激光通量为零)。尽管这些TR-XSS数据表明,激光诱导的洗涤剂溶解样品的视紫红质加热随泵浦激光脉冲通量线性变化,但这并不意味着光激发发生在每个发色团的单光子线性响应极限内。此外,在这个时间尺度上存储在蛋白质内的任何能量(例如,视网膜内的应变)在TR-XSS数据中不会作为加热可见,因此任何可测量的高于光子当量的一部分的加热意味着多余的能量通过多光子吸收途径进入系统。gydF4y2Ba
使用扩展数据图。gydF4y2Ba3 hgydF4y2Ba作为激光加热诱导的校准曲线,我们可以估计使用GDVN液体微射流注入的洗涤剂溶解的视紫红质样品中引起的温度跳变(通量为140 mJ cm)gydF4y2Ba−2gydF4y2BaFWHM的平均值)将是ΔgydF4y2BaTgydF4y2Ba= 0.016±0.009°c;当暴露于SACLA使用的光激发(260兆焦耳厘米的影响gydF4y2Ba−2gydF4y2BaFWHM的平均值)将是ΔgydF4y2BaTgydF4y2Ba= 0.028±0.016°c。使用每个分子吸收光子的公式= ΔgydF4y2BaTgydF4y2Ba×gydF4y2BaCgydF4y2BaPgydF4y2Ba/((视紫红质)×gydF4y2Ba一个gydF4y2Ba×gydF4y2BahνgydF4y2Ba),gydF4y2BaCgydF4y2BaPgydF4y2Ba= 3.8 J cmgydF4y2Ba−3gydF4y2Ba作为膜蛋白在洗涤剂含量高的溶液中的近似热容(参考文献表2)。gydF4y2Ba19gydF4y2Ba),gydF4y2Ba一个gydF4y2Ba为阿伏伽德罗常数,gydF4y2BahgydF4y2Ba为普朗克常数,gydF4y2BaνgydF4y2Ba=gydF4y2BacgydF4y2Ba/gydF4y2BaλgydF4y2Ba为泵浦激光光子的频率,gydF4y2BacgydF4y2Ba光速和gydF4y2BaλgydF4y2Ba是泵浦激光波长。这些加热变化对应于在瑞士fel的光激发条件下,视紫红质发色团吸收了额外的1.2±0.7个光子,在SACLA的光激发条件下,吸收了额外的2.1±1.2个光子。然而,在将这些估计值外推到我们的TR-SFX研究之前,必须承认有相当大的不确定性。最重要的三个考虑因素是,适当的TR-XSS对照研究应使用与TR-XSS和TR-SFX研究相似的样品制剂进行,并使用相同的微喷射注射器(即在LCP中制备并使用粘性注射器注射的视紫红质);上述估计假设x射线束和激光焦点之间实现了良好的空间重叠,并且在LCLS的TR-XSS数据收集期间,这没有实质性的漂移;理想情况下,在TR-XSS和TR-SFX实验中,应使用相同的fs激光器进行光激发,并使用相同的工具测量激光聚焦光斑直径。尽管这些缺点增加了不确定性,但上述估计数明显低于按gydF4y2BaσFgydF4y2Ba/gydF4y2BahνgydF4y2Ba= 45的光激发条件用于瑞士fel和gydF4y2BaσFgydF4y2Ba/gydF4y2BahνgydF4y2Ba= 81的光激发条件在SACLA使用(gydF4y2BaσgydF4y2Ba480海里gydF4y2Ba= 34,000米gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba).关于TR-SFX研究的适当光激发条件是什么,一直存在相当大的争论gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.我们的TR-XSS观察表明,与其他关于其他光敏蛋白的TR-XSS研究一样gydF4y2Ba3 gydF4y2Ba,激光诱导样品加热不能被产品准确预测gydF4y2BaσFgydF4y2Ba/gydF4y2BahνgydF4y2Ba.这可能是由于在480 nm处第一激发态的横截面比基态的横截面要小得多;可能是由于光激发态具有相对较高的受激拉曼散射和受激发射截面,因此吸收的多余能量被发射的光子带走,而不是作为样品加热可见;微射流的散射会造成一定的能量损失;可能还有其他我们还不了解的因素。在上述TR-XSS研究中,视紫红质在晶体中浓度为4 mM,但在0.2 mM进行调整后,这些加热估计意味着,晶体内的温度跳跃不太可能像细菌视紫红质的TR-SFX研究中所声称的那样达到100°C的量级gydF4y2Ba32gydF4y2Ba同样不太可能的是,我们的TR-SFX数据是由激光诱导加热引起的准各向同性结构膨胀所主导的,在TR-XSS研究中,在一个光合反应中心观察到大约800个光子被每个发色团吸收gydF4y2Ba65gydF4y2Ba.gydF4y2Ba
数据处理gydF4y2Ba
所有数据都使用INDEXAMAJIG和XGANDALF算法对SwissFEL (SF dark, 1 ps, 10 ps)和MOSFLM收集的数据进行索引gydF4y2Ba66gydF4y2Ba, DirAxgydF4y2Ba67gydF4y2Ba和XGANDALFgydF4y2Ba68gydF4y2Ba在SACLA收集数据的算法(SACLA暗,100 ps)。SwissFEL数据的积分半径设置为2像素,SACLA数据的积分半径设置为3像素,而SwissFEL数据的背景环空设置为4至6像素,SACLA收集的数据的背景环空设置为4至7像素。晶体到探测器的距离在每次运行的基础上进行了优化,首先以200µm采样探测器距离在91.5 mm到97.5 mm (SwissFEL)之间,然后以47.5 mm到53.5 mm (SACLA)之间,然后以20µm增量来确定探测器距离,在此距离下,单位细胞尺寸的标准偏差最小化。gydF4y2Ba
在PARTIALATOR中分别对SwissFEL和SACLA数据进行缩放和合并gydF4y2Ba69gydF4y2Ba,使用XSPHERE偏心建模gydF4y2Ba70gydF4y2Ba.自定义分裂用于输出单独的暗和光激活反射文件,为每个自由电子激光器收集的数据。gydF4y2Ba
在晶体中发现了晶格易位缺陷gydF4y2Ba36gydF4y2Ba在用phenix.xtriage检查帕特森地图后gydF4y2Ba71gydF4y2Ba.特别地,在td =(0.000, 0.245, 0.000)处的Patterson峰('平移向量(gydF4y2Ba道明gydF4y2Ba)的扩展数据表gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1 d - igydF4y2Ba)被归因于晶体中存在两个翻译相关的结构域。修正gydF4y2Ba36gydF4y2Ba检索单域强度所需的强度已在前面描述过gydF4y2Ba72gydF4y2Ba,翻译域内分子的百分比(gydF4y2BaκgydF4y2Ba)('翻译分数(gydF4y2BakgydF4y2Ba)的扩展数据表gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1 d - igydF4y2Ba)是通过修正增加时的强度来确定的gydF4y2BaκgydF4y2Ba值以1%的增量从0%到50%,直到(0.000,0.245,0.000)帕特森峰值被压平。该修正导致SACLA暗态Rfree从26.11%降低到23.92%,并提高了暗态电子密度图的可解释性,从而进一步改进了模型(扩展数据图。gydF4y2Ba1 d - igydF4y2Ba).gydF4y2Ba
视紫红质暗态的结构测定与精制gydF4y2Ba
PDBgydF4y2Ba1日19gydF4y2Ba(ref。gydF4y2Ba73gydF4y2Ba),去除溶剂和配体分子,作为Phaser MR中的分子替换搜索模型gydF4y2Ba74gydF4y2Ba.利用Phenix.refine软件进行多次迭代优化和迭代建模后,得到了暗态结构gydF4y2Ba75gydF4y2Ba和傻瓜gydF4y2Ba76gydF4y2Ba.使用JLigand生成了一个额外的配体几何文件,以抑制连接赖氨酸侧链和视网膜的PSB的几何结构gydF4y2Ba77gydF4y2Ba.gydF4y2Ba
计算密度差图gydF4y2Ba
FgydF4y2BaogydF4y2Ba(光),gydF4y2BaFgydF4y2BaogydF4y2Ba(暗)振幅由晶格平移缺陷校正强度计算gydF4y2Baphenix.french_wilsongydF4y2Ba71gydF4y2Ba而且gydF4y2BaFgydF4y2BaogydF4y2Ba(光)−gydF4y2BaFgydF4y2BaogydF4y2Ba(暗)差图使用phenix.fobs_minus_fobs_map计算gydF4y2Ba71gydF4y2Ba使用多重缩放选项排除小于3的振幅gydF4y2BaσgydF4y2Ba并且在9 Å和1.8 Å之间的分辨率范围内使用反射。所有gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(光)−gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(暗)的计算使用的阶段的细化暗状态。gydF4y2Ba
计算gydF4y2BaFgydF4y2BacalcgydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba差分图,gydF4y2BaFgydF4y2BacalcgydF4y2Ba使用SFall计算振幅,使用Scaleit对实验数据进行缩放,使用FFT计算差分图,分辨率为1.7 Å,所有程序都可在CCP4套件中获得gydF4y2Ba78gydF4y2Ba.gydF4y2Ba
为了整合和绘制通量响应曲线的密度,在瑞士fel记录的两个10 ps光数据集和1 ps光数据集被缩减到最小数据集的大小(约29,000个模式)。这些数据被比比例和合并描述为地图计算,和差图计算完全相同的方式。基于ref的自定义MATLAB脚本。gydF4y2Ba79gydF4y2Ba用于以CgydF4y2Ba20.gydF4y2Ba和CgydF4y2Ba12gydF4y2Ba激发态的原子。然后用密度与通量作对比。gydF4y2Ba
数据外推gydF4y2Ba
外推数据的计算使用晶格平移校正数据,并根据前面描述的方法gydF4y2Ba80gydF4y2Ba.线性近似方法如下:gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba= 100 /gydF4y2Ba一个gydF4y2Ba×(gydF4y2BaFgydF4y2BaobgydF4y2Ba(光)−gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba) +(黑暗)gydF4y2BaFgydF4y2BacalcgydF4y2Ba,在那里gydF4y2Ba一个gydF4y2Ba激活水平以百分比表示,gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba表示外推的结构因子振幅和gydF4y2BaFgydF4y2BacalcgydF4y2Ba表示暗态模型的计算振幅。每个时间点的激活级别是使用前面描述的方法独立确定的gydF4y2Ba80gydF4y2Ba.简而言之,计算外推数据时,激活水平范围为10%至50%,增量为1%gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba计算了来自暗态模型的差分图和相位。- 2gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2BaC附近密度gydF4y2Ba11gydF4y2BaCgydF4y2Ba12gydF4y2Ba和CgydF4y2Ba20.gydF4y2Ba视网膜,在视网膜上显示负密度特征gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(光)−gydF4y2BaFgydF4y2Ba奥林匹克广播服务公司gydF4y2Ba(暗)地图,被整合的半径为1.5 Å以上在1.5gydF4y2BaσgydF4y2Ba每个激活级别的截止日期。- 2gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba差异密度绘制为激活水平的函数;当高估激活水平时,很少有2gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba这些原子位置的密度差为负,而大小为负2gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba当激活水平被低估时,差异密度增大。然后,通过计算图的两个线性部分之间的交集来确定激活水平,以找到负密度开始出现的激活水平。由于在不同的实验条件下收集了三个光激活数据集,因此分别独立计算(SwissFEL 1 ps 21%, SwissFEL 10 ps 20%, SACLA 100 ps 22%)。gydF4y2Ba
光激活态的细化gydF4y2Ba
利用Phenix.refine中1-ps和10-ps时间点的外推数据,使用SwissFEL的暗态模型作为初始模型进行细化gydF4y2Ba75gydF4y2Ba,与Coot互动模型构建gydF4y2Ba76gydF4y2Ba是为了将模型与2gydF4y2BaFgydF4y2Ba额外的gydF4y2Ba−gydF4y2BaFgydF4y2BacalcgydF4y2Ba映射和去除缺乏电子密度的水分子。以SACLA暗态模型为起点,从SACLA 100-ps数据开始执行相同的迭代过程。gydF4y2Ba
残留编号gydF4y2Ba
除了根据它们在主序列中的位置给出一个数字外,视紫红质中的残基还根据Ballesteros-Weinstein方案被分配一个“一般”数字gydF4y2Ba81gydF4y2Ba.ballestero - weinstein一般数由两个用圆点分隔的数组成,其中第一个表示螺旋(1到8),第二个表示相对于该螺旋中最保守的残余的位置,任意分配为50。例如,Glu113gydF4y2Ba3.28gydF4y2Ba表示反离子Glu113位于TM3中,在TM3中最保守的残基(Arg135)之前有22个残基gydF4y2Ba3.50gydF4y2Ba).gydF4y2Ba
本研究中大多数氨基酸的Ballesteros编号为Met44gydF4y2Ba1.39gydF4y2Ba, Met86gydF4y2Ba2.53gydF4y2Ba, Phe91gydF4y2Ba2.58gydF4y2Ba, Thr94gydF4y2Ba2.61gydF4y2Ba, Glu113gydF4y2Ba3.28gydF4y2Ba, Ala117gydF4y2Ba3.32gydF4y2Ba, Thr118gydF4y2Ba3.33gydF4y2Ba, Cys110gydF4y2Ba3.25gydF4y2Ba, Gly120gydF4y2Ba3.35gydF4y2Ba, Gly121gydF4y2Ba3.36gydF4y2Ba, Glu122gydF4y2Ba3.37gydF4y2Ba, Met207gydF4y2Ba5.42gydF4y2Ba, His211gydF4y2Ba5.46gydF4y2Ba, Phe212gydF4y2Ba5.47gydF4y2Ba, Pro215gydF4y2Ba5.50gydF4y2Ba, Phe261gydF4y2Ba6.44gydF4y2Ba, Trp265gydF4y2Ba6.48gydF4y2Ba, Pro267gydF4y2Ba6.50gydF4y2Ba, Tyr268gydF4y2Ba6.51gydF4y2Ba, Ala269gydF4y2Ba6.52gydF4y2Ba, Ala292gydF4y2Ba7.39gydF4y2Ba, Phe293gydF4y2Ba7.40gydF4y2Ba和Lys296gydF4y2Ba7.43gydF4y2Ba.gydF4y2Ba
水命名法gydF4y2Ba
W01(链C/HOH #01)在C端gydF4y2Ba20.gydF4y2Ba/受潮湿腐烂;W02 (C/HOH #02链)Ser186;对离子Glu113 (Gly90, Phe91, Ala117)近端W03(链C/HOH #103);W04(链C/HOH #119)在Met86 (Phe91, Phe116, Ala117),低使用率增加ΔgydF4y2BatgydF4y2Ba= 1 ps,由Δ重置gydF4y2BatgydF4y2Ba= 100 ps。gydF4y2Ba
QM / MM计算gydF4y2Ba
本工作中报道的TR‐SFX晶体结构被用作计算的初始几何结构。利用PROPKA程序获得蛋白中可滴定氨基酸残基在pH 9.0时的pKa值gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba.随后,根据之前计算的pKa值,使用AMBER软件包中的程序tleap对蛋白质进行质子化gydF4y2Ba84gydF4y2Ba在对视网膜和Lys296施加位置限制的同时,我们首先进行了短的(50步)分子力学(MM)能量最小化gydF4y2Ba7.43gydF4y2Ba缓解空间冲突。随后,利用混合QM/MM优化了视紫红质暗态和光态(1 ps和100 ps)的几何形状gydF4y2Ba85gydF4y2Ba在气相。在模拟过程中,蛋白质的骨架被冷冻。在最简单的系统中,QM部分仅由视网膜发色团和形成质子化希夫碱(RPSB)的Lys296侧链组成。氢键原子(HLA)方案gydF4y2Ba86gydF4y2Ba用于将QM/MM边界置于CgydF4y2BaδgydF4y2Ba和CgydF4y2BaεgydF4y2BaLys296侧链上的原子。我们还考虑了一个更扩展的QM区域,包括近端反离子(Glu113gydF4y2Ba3.28gydF4y2Ba),祖传反离子(Glu181 .gydF4y2BaECL2gydF4y2Ba), Ser186gydF4y2BaECL2gydF4y2Ba, Tyr191gydF4y2BaECL2gydF4y2Ba, Tyr268gydF4y2Ba6.51gydF4y2Ba和水W01。QM部分使用BP86‐D3(BJ)函数进行描述gydF4y2Ba87gydF4y2Ba,gydF4y2Ba88gydF4y2Ba与cc‐pVDZ基集结合使用gydF4y2Ba89gydF4y2Ba以及用于识别身份的def2/J辅助基集gydF4y2Ba90gydF4y2Ba.球链交换(COSX)算法与库仑项(RI‐J)的单位分辨率结合使用。剩余的蛋白用Amber ff14SB力场处理gydF4y2Ba91gydF4y2Ba.采用TIP3P模型描述水分子gydF4y2Ba92gydF4y2Ba.QM/MM优化是使用量子化学程序Orca (v.5.0.2)进行的。gydF4y2Ba93gydF4y2Ba与ChemShell (v.3.7.1)软件包的DL_POLY模块接口gydF4y2Ba94gydF4y2Ba,gydF4y2Ba95gydF4y2Ba.最小基态几何和部分电荷被用于计算RI‐ADC(2)理论水平的垂直激发能gydF4y2Ba96gydF4y2Ba冻结核心轨道和cc‐pVTZ基与相应的辅助基相结合gydF4y2Ba89gydF4y2Ba.此外,为了考虑QM/MM几何优化对激发的影响,我们计算了最简单QM/MM系统暗态和底态部分MM最小化结构的垂直激发能量。RI‐ADC(2)的计算使用Turbomole (v.7.5.1)程序包进行gydF4y2Ba97gydF4y2Ba.所有的计算都是使用保罗·谢勒研究所的超级计算设施进行的。gydF4y2Ba
分子动力学模拟gydF4y2Ba
我们使用来自GPCRmd数据库的分子动力学模拟数据gydF4y2Ba98gydF4y2Ba,一个开放获取的研究资源,拥有迄今为止解决的大多数GPCR 3D结构的分子动力学模拟的综合数据集。GPCRmd提供了几种工具来交互式地分析模拟轨迹,或者,它们可以下载并在本地进行分析。具体来说,我们将视紫红质的三个模拟副本(3 × 2500帧)连接在一起(PDB:gydF4y2Ba1 gzmgydF4y2Ba;轨迹id 16414, 16415和16416)嵌入到与水和离子溶剂化的脂质双分子层中,并模拟1.5µs的聚合时间(即每个副本500ns)。我们使用了Python (v.3.10)和MDanalysis库gydF4y2Ba99gydF4y2Ba,gydF4y2BaOne hundred.gydF4y2Ba获取模拟数据,计算蛋白质Cα原子的平均均方根波动。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
坐标和结构因子已根据登录代码存入PDBgydF4y2Ba7中标经略gydF4y2Ba(SFX在SACLA获得的暗态视紫红质),gydF4y2Ba7 zbegydF4y2Ba(SFX在瑞士fel获得的暗态视紫红质),gydF4y2Ba8 a6cgydF4y2Ba(在SwissFEL通过TR-SFX获得1 ps光激活后的视紫红质),gydF4y2Ba8 a6dgydF4y2Ba(在瑞士fel通过TR-SFX获得10 ps光激活后的视紫红质)和gydF4y2Ba8 a6egydF4y2Ba(在SACLA通过TR-SFX获得100 ps光激活后的视紫红质)。gydF4y2Ba
代码的可用性gydF4y2Ba
电子密度差图(gydF4y2BaFgydF4y2BaO(光、1,10和100ps时延)gydF4y2Ba−gydF4y2BaFgydF4y2Bao(黑)gydF4y2Ba)的哺乳动物视紫红质光激活速率分别为1,10,100 ps,可在瑞士国家超级计算中心CSCS存储库(gydF4y2Bahttps://doi.org/10.16907/577a2a74-22ea-4d01-87af-6a99447a430fgydF4y2Ba).晶格平动无序修正和电子密度外推图计算的代码可在Zenodo (gydF4y2Bahttps://doi.org/10.5281/zenodo.7560364gydF4y2Ba).gydF4y2Ba
参考文献gydF4y2Ba
霍夫曼,K. P.等人。工作中的G蛋白偶联受体:视紫红质模型。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba34gydF4y2Ba, 540-552(2009)。gydF4y2Ba
Schoenlein, R. W., Peteanu, L. A., Mathies, R. A. & Shank, C. V.视觉的第一步:视紫红质的飞秒异构化。gydF4y2Ba科学gydF4y2Ba254gydF4y2Ba, 412-415(1991)。gydF4y2Ba
布兰登,G.和neuze, R.时间分辨大分子晶体学的进展和挑战。gydF4y2Ba科学gydF4y2Ba373gydF4y2Ba, eaba0954(2021)。gydF4y2Ba
Sakmar, T. P., Franke, R. R. & Khorana, H. G.谷氨酸-113作为牛视紫红质的视黄醛席夫碱反离子。gydF4y2Ba国家科学院学报美国gydF4y2Ba86gydF4y2Ba, 8309-8313(1989)。gydF4y2Ba
Palczewski, K.等人。视紫红质晶体结构:一种G蛋白偶联受体。gydF4y2Ba科学gydF4y2Ba289gydF4y2Ba, 739-745(2000)。gydF4y2Ba
Terakita, A.等。视紫红质家族分子进化中的反离子置换。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba11gydF4y2Ba, 284-289(2004)。gydF4y2Ba
小岛,等人。在被膜视蛋白中涉及反离子置换的进化步骤。gydF4y2Ba国家科学院学报美国gydF4y2Ba114gydF4y2Ba, 6028-6033(2017)。gydF4y2Ba
Terakita, A., Yamashita, T. & Shichida, Y.视紫红质细胞外IV-V环中高度保守的谷氨酸在视紫红质家族成员视网膜色素中起反离子作用。gydF4y2Ba国家科学院学报美国gydF4y2Ba97gydF4y2Ba, 14263-14267(2000)。gydF4y2Ba
中道,H. & Okada, T.视紫红质光反应中间体的局部肽运动。gydF4y2Ba国家科学院学报美国gydF4y2Ba103gydF4y2Ba, 12729-12734(2006)。gydF4y2Ba
中道,H. &冈田,T.初级视觉光化学的晶体学分析。gydF4y2BaAngew。化学。Int。艾德,心血管病。gydF4y2Ba45gydF4y2Ba, 4270-4273(2006)。gydF4y2Ba
斯坦德弗斯,J.等。激动剂诱导激活组成型活性视紫红质的结构基础。gydF4y2Ba自然gydF4y2Ba471gydF4y2Ba, 656-660(2011)。gydF4y2Ba
崔,H. W., Park, J. H., Kim, Y. J. & Ernst, O. P. GPCRs跨膜信号:视紫红质和视蛋白结构的洞察。gydF4y2Ba神经药理学gydF4y2Ba60gydF4y2Ba, 52-57(2011)。gydF4y2Ba
Deupi, x等。稳定的G蛋白结合位点在组成型活性化脓紫红素ii的结构中。gydF4y2Ba国家科学院学报美国gydF4y2Ba109gydF4y2Ba, 119-124(2012)。gydF4y2Ba
Gozem, S., Luk, H. L., Schapiro, I. & Olivucci, M.生物发色团超快双键异构化的理论和模拟。gydF4y2Ba化学。牧师。gydF4y2Ba117gydF4y2Ba, 13502-13565(2017)。gydF4y2Ba
恩斯特,o.p.等人。微生物和动物视紫红质:结构、功能和分子机制。gydF4y2Ba化学。牧师。gydF4y2Ba114gydF4y2Ba, 126-163(2014)。gydF4y2Ba
施奈德曼,C.等人。视觉光化学振动相位依赖同位素效应的证据。gydF4y2BaNat,化学。gydF4y2Ba10gydF4y2Ba, 449-455(2018)。gydF4y2Ba
杨,等。视紫红质的量子经典模拟揭示了激发态种群分裂及其对量子效率的影响。gydF4y2BaNat,化学。gydF4y2Ba14gydF4y2Ba, 441-449(2022)。gydF4y2Ba
时间分辨大分子晶体学的前沿:电影和啁啾x射线脉冲。gydF4y2Ba法拉第讨论。gydF4y2Ba122gydF4y2Ba, 65-77(2003)。gydF4y2Ba
巴伦兹,T. R.等人。直接观察CO肌红蛋白在配体解离时的超快集体运动。gydF4y2Ba科学gydF4y2Ba350gydF4y2Ba, 445-450(2015)。gydF4y2Ba
Tenboer, J.等人。时间分辨系列晶体学捕获光活性黄色蛋白的高分辨率中间产物。gydF4y2Ba科学gydF4y2Ba346gydF4y2Ba, 1242-1246(2014)。gydF4y2Ba
潘德,K.等。飞秒结构动力学驱动光活性黄蛋白的反式/顺式异构化。gydF4y2Ba科学gydF4y2Ba352gydF4y2Ba, 725-729(2016)。gydF4y2Ba
Coquelle, N.等。通过时间分辨序列飞秒晶体学捕获的光可切换荧光蛋白激发态下的发色团扭曲。gydF4y2BaNat,化学。gydF4y2Ba10gydF4y2Ba, 31-37(2018)。gydF4y2Ba
克莱森,E.等人。飞秒x射线激光捕获光敏色素蛋白的主要结构光响应。gydF4y2BaeLifegydF4y2Ba9gydF4y2Ba, e53514(2020)。gydF4y2Ba
诺格利,P.等人。飞秒x射线激光捕获细菌视紫红质的视网膜异构化。gydF4y2Ba科学gydF4y2Ba361gydF4y2Ba, eaat0094(2018)。gydF4y2Ba
纳斯·科瓦奇,G.等。光激发细菌视紫红质的超快动力学三维视图。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 3177(2019)。gydF4y2Ba
Skopintsev, P.等人。光驱动钠泵飞秒到毫秒的结构变化。gydF4y2Ba自然gydF4y2Ba583gydF4y2Ba, 314-318(2020)。gydF4y2Ba
Mous, S.等人。一种轻型氯泵的动力学与机理。gydF4y2Ba科学gydF4y2Ba375gydF4y2Ba, 845-851(2022)。gydF4y2Ba
Dods, R.等人。光合反应中心内的超快结构变化。gydF4y2Ba自然gydF4y2Ba589gydF4y2Ba, 310-314(2021)。gydF4y2Ba
Aller, P. & Orville, a.m。XFEL或同步加速器源的动态结构生物学实验。gydF4y2Ba方法分子生物学。gydF4y2Ba2305gydF4y2Ba, 203-228(2021)。gydF4y2Ba
兰尼克等人。使用时间分辨系列晶体学观察光药理药物从微管蛋白释放。gydF4y2BaCommun Nat。gydF4y2Ba14gydF4y2Ba, 903(2023)。gydF4y2Ba
格伦拜因,m.l.等。系列飞秒晶体学超快泵浦探针实验的照明指南。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 681-684(2020)。gydF4y2Ba
Miller, R. J. D., Pare-Labrosse, O., Sarracini, A. & Besaw, J. E.光激发菌视紫红质在多光子体系中超快动力学的三维视图和生物学相关性。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 1240(2020)。gydF4y2Ba
巴伦兹,T. R. M.等人。泵浦激光照射对肌红蛋白超快结构变化的影响。预印在gydF4y2Bahttps://doi.org/10.1101/2022.11.22.517513gydF4y2Ba(2022)。gydF4y2Ba
用于结构测定的膜蛋白结晶:脂质中间相的使用。gydF4y2Ba为基础。启Biophys。gydF4y2Ba38gydF4y2Ba, 29-51(2009)。gydF4y2Ba
Fotiadis, D.等人。视紫红质二聚体的结构:g蛋白偶联受体的工作模型。gydF4y2Ba咕咕叫。当今。结构体。医学杂志。gydF4y2Ba16gydF4y2Ba, 252-259(2006)。gydF4y2Ba
罗德里格斯,J. R., Casadei C. M., Weinert T., Panneels, V. & Schertler, G. F. X.对晶格易位缺陷的视紫红质系列晶体衍射强度的校正。gydF4y2BaActa Crystallogr。DgydF4y2Ba79gydF4y2Ba, 224-233(2023)。gydF4y2Ba
李,J.,爱德华兹,P. C., Burghammer, M.,维拉,C. & Schertler, g.f.牛视紫红质在三角晶体形式的结构。gydF4y2BaJ. Mol.生物学。gydF4y2Ba343gydF4y2Ba, 1409-1438(2004)。gydF4y2Ba
Yan, E. C.等。G蛋白偶联受体视紫红质的光激活中的视网膜反离子开关。gydF4y2Ba国家科学院学报美国gydF4y2BaOne hundred.gydF4y2Ba, 9262-9267(2003)。gydF4y2Ba
Kimata, N.等人。视紫红质的视网膜定向和相互作用揭示了激活的两阶段触发机制。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba, 12683(2016)。gydF4y2Ba
吉泽文,张志刚,张志刚。视紫红质中间体低温分光光度法的研究。gydF4y2BaEnzymol方法。gydF4y2Ba81gydF4y2Ba, 333-354(1982)。gydF4y2Ba
Kukura, P., McCamant, D. W., Yoon, S., Wandschneider, D. B. & Mathies, R. A.飞秒刺激拉曼视觉初级异构化的结构观察。gydF4y2Ba科学gydF4y2Ba310gydF4y2Ba, 1006-1009(2005)。gydF4y2Ba
视紫红质:一种典型的G蛋白偶联受体。gydF4y2Ba掠夺。核酸Res. Mol. Biol。gydF4y2Ba59gydF4y2Ba, 1-34(1998)。gydF4y2Ba
Lewis, J. W., Szundi, I., Kazmi, M. A., Sakmar, T. P. & Kliger, D. S.视紫红质谷氨酸181突变体的时间分辨光中间体变化。gydF4y2Ba生物化学gydF4y2Ba43gydF4y2Ba, 12614-12621(2004)。gydF4y2Ba
爱德华兹,C.等。用激光产生的超声波和杨氏模量测量估计蛋白质晶体中的热运动。gydF4y2BaActa Crystallogr。一个gydF4y2Ba46gydF4y2Ba, 315-320(1990)。gydF4y2Ba
Nagata, T., Oura, T., Terakita, A., Kandori, H. & Shichida, Y.视紫红质中视网膜发色团与苏氨酸-118的异构体特异性相互作用。gydF4y2Ba期刊。化学。gydF4y2Ba106gydF4y2Ba, 1969-1975(2002)。gydF4y2Ba
Yan, E. C.等。初级视觉光产物能量储存和发色团畸变机理的共振拉曼分析。gydF4y2Ba生物化学gydF4y2Ba43gydF4y2Ba, 10867-10876(2004)。gydF4y2Ba
视觉过程中第一步的自行车踏板模型。gydF4y2Ba自然gydF4y2Ba260gydF4y2Ba, 678-683(1976)。gydF4y2Ba
Andruniow, T., Ferre, N. & Olivucci, M.结构、初始激发态弛豫和视紫红质的能量存储在多构型微扰理论水平上解决。gydF4y2Ba国家科学院学报美国gydF4y2Ba101gydF4y2Ba, 17908-17913(2004)。gydF4y2Ba
Frutos, L. M., Andruniow, T., Santoro, F., Ferre, N. & Olivucci, M.用多构型量子化学跟踪视觉色素的激发态时间演化。gydF4y2Ba国家科学院学报美国gydF4y2Ba104gydF4y2Ba, 7764-7769(2007)。gydF4y2Ba
森,S, Kar, R. K, Borin, V. A. & Schapiro, I.从混合量子力学/分子力学模拟对视网膜蛋白异构化机制的洞察。gydF4y2Ba电线第一版。摩尔。科学。gydF4y2Ba12gydF4y2Ba, e1562(2022)。gydF4y2Ba
兰德尔,c.e.等人。一种新的光解中间体在人造和天然视觉色素。gydF4y2Ba江淮gydF4y2Ba113gydF4y2Ba, 3473-3485(1991)。gydF4y2Ba
Birge, R. R. & Vought, B. W.视紫红质光漂白的能量学:早期和后期中间体能量储存的光热学研究。gydF4y2BaEnzymol方法。gydF4y2Ba315gydF4y2Ba, 143-163(2000)。gydF4y2Ba
Karnik, S. S. & Khorana, H. G.功能性视紫红质的组装需要半胱氨酸残基110和187之间的二硫键。gydF4y2Ba生物。化学。gydF4y2Ba265gydF4y2Ba, 17520-17524(1990)。gydF4y2Ba
Deupi, X. & Kobilka, B. K.能源景观作为集成GPCR结构、动力学和功能的工具。gydF4y2Ba生理学gydF4y2Ba25gydF4y2Ba, 293-303(2010)。gydF4y2Ba
Venkatakrishnan, A. J.等人。A类GPCRs中不同的激活途径汇聚在g蛋白偶联区附近。gydF4y2Ba自然gydF4y2Ba536gydF4y2Ba, 484-487(2016)。gydF4y2Ba
Hauser, A. S.等人。GPCR激活机制跨越类别和宏/微尺度。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba28gydF4y2Ba, 879-888(2021)。gydF4y2Ba
Venkatakrishnan, A. J.等人。g蛋白偶联受体的分子特征。gydF4y2Ba自然gydF4y2Ba494gydF4y2Ba, 185-194(2013)。gydF4y2Ba
华莱士,a.c.,拉斯科夫斯基,r.a.,辛格,J. &桑顿,J. M.蛋白质的分子识别:从结构角度看蛋白质-配体相互作用。gydF4y2Ba物化学。Soc。反式。gydF4y2Ba24gydF4y2Ba, 280-284(1996)。gydF4y2Ba
Okada, T, Takeda, K. & Kouyama, T.使用二价阳离子和烷基(硫)葡萄糖苷组合从牛棒外段膜中高选择性分离视紫红质。gydF4y2BaPhotochem。Photobiol。gydF4y2Ba67gydF4y2Ba, 495-499(1998)。gydF4y2Ba
爱德华,P. C.等。天然和改性牛视紫红质及其重原子衍生物的晶体。gydF4y2BaJ. Mol.生物学。gydF4y2Ba343gydF4y2Ba, 1439-1450(2004)。gydF4y2Ba
李志强,王志强,王志强,等。手性晶体的二阶非线性光学成像。gydF4y2Ba安。启肛门。化学。gydF4y2Ba4gydF4y2Ba, 419-437(2011)。gydF4y2Ba
詹姆斯,D.等人。改进x射线激光时间分辨序列飞秒晶体学微晶体的高粘度挤压。gydF4y2BaJ. Vis. Exp。gydF4y2Ba144gydF4y2Ba, e59087(2019)。gydF4y2Ba
托诺,K.等。SACLA (DAPHNIS)硬x射线衍射的多样化应用平台:使用x射线自由电子激光应用于序列蛋白质晶体学。gydF4y2BaJ.同步辐射。gydF4y2Ba22gydF4y2Ba, 532-537(2015)。gydF4y2Ba
岛津,Y.等人。常压连续飞秒晶体学用高粘度样品注入装置。gydF4y2Baj:。Crystallogr。gydF4y2Ba52gydF4y2Ba, 1280-1288(2019)。gydF4y2Ba
Arnlund等人。在自由电子激光上用时间分辨x射线散射可视化蛋白质地震。gydF4y2BaNat方法。gydF4y2Ba11gydF4y2Ba, 923-926(2014)。gydF4y2Ba
大分子衍射数据的整合。gydF4y2BaActa Crystallogr。DgydF4y2Ba62gydF4y2Ba, 48-57(2006)。gydF4y2Ba
用固定反射表进行单晶衍射的分度。gydF4y2Baj:。Crystallogr。gydF4y2Ba25gydF4y2Ba, 92-96(1992)。gydF4y2Ba
格沃科夫,Y.等人。xgandalf -扩展梯度下降算法的格子查找。gydF4y2BaActa Crystallogr。一个gydF4y2Ba75gydF4y2Ba, 694-704(2019)。gydF4y2Ba
怀特,t.a.等。CrystFEL:用于快照串行晶体学的软件套件。gydF4y2Baj:。结晶的。gydF4y2Ba45gydF4y2Ba, 335-334(2012)。gydF4y2Ba
用CrystFEL处理连续晶体学数据:一步一步的指南。gydF4y2BaActa Crystallogr。DgydF4y2Ba75gydF4y2Ba, 219-233(2019)。gydF4y2Ba
亚当斯,P. D.等。PHENIX:构建自动化晶体结构测定的新软件。gydF4y2BaActa Crystallogr。DgydF4y2Ba58gydF4y2Ba, 1948-1954(2002)。gydF4y2Ba
王俊杰,王俊杰,王俊杰,王俊杰,王俊杰。含晶格易位缺陷的单晶x射线强度的修正。gydF4y2BaActa Crystallogr。DgydF4y2Ba61gydF4y2Ba, 67-74(2005)。gydF4y2Ba
冈田,T.等。视紫红质中的视网膜构象及其环境,根据新的2.2 Å晶体结构。gydF4y2BaJ. Mol.生物学。gydF4y2Ba342gydF4y2Ba, 571-583(2004)。gydF4y2Ba
麦考伊,A. J.等人。相位晶体学软件。gydF4y2Baj:。Crystallogr。gydF4y2Ba40gydF4y2Ba, 658-674(2007)。gydF4y2Ba
Liebschner, D.等人。使用x射线、中子和电子测定大分子结构:Phenix的最新进展。gydF4y2BaActa Crystallogr。DgydF4y2Ba75gydF4y2Ba, 861-877(2019)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.白骨顶的特征与发育。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
列别捷夫,a.a.等人。JLigand: CCP4模板约束库的图形化工具。gydF4y2BaActa Crystallogr。DgydF4y2Ba68gydF4y2Ba, 431-440(2012)。gydF4y2Ba
协作计算项目,第4题。CCP4套件:蛋白质结晶学程序。gydF4y2BaActa Crystallogr。DgydF4y2Ba50gydF4y2Ba, 760-763(1994)。gydF4y2Ba
Wickstrand, C.等人。在时间分辨晶体学中可视化蛋白质运动的工具。gydF4y2Ba结构体。直流发电机。gydF4y2Ba7gydF4y2Ba, 024701(2020)。gydF4y2Ba
潘迪,S.等。欧洲XFEL的时间分辨序列飞秒晶体学。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 73-78(2020)。gydF4y2Ba
Ballesteros, A. & Weinstein, H.构建三维模型的集成方法和G蛋白偶联受体结构-功能关系的计算探测。gydF4y2Ba方法>。gydF4y2Ba25gydF4y2Ba, 366-428(1995)。gydF4y2Ba
Olsson, m.h, Sondergaard, c.r, Rostkowski, M. & Jensen, j.h. PROPKA3:经验pKa预测中内部和表面残留物的一致处理。gydF4y2Baj .化学。理论第一版。gydF4y2Ba7gydF4y2Ba, 525-537(2011)。gydF4y2Ba
Sondergaard, C. R., Olsson, M. H., Rostkowski, M. & Jensen, J. H.在经验计算和pKa值合理化中的配体和耦合效应的改进处理。gydF4y2Baj .化学。理论第一版。gydF4y2Ba7gydF4y2Ba, 2284-2295(2011)。gydF4y2Ba
Case, d.a.等。gydF4y2Ba2021年琥珀gydF4y2Ba(加州大学,旧金山,2021)。gydF4y2Ba
Senn, H. M. & Thiel, W.生物分子系统的QM/MM方法。gydF4y2BaAngew。化学。Int。艾德,心血管病。gydF4y2Ba48gydF4y2Ba, 1198-1229(2009)。gydF4y2Ba
菲尔德,M. J.,巴什,P. A. & Karplus, M. A.结合量子力学和分子力学势进行分子动力学模拟。gydF4y2Baj .第一版。化学。gydF4y2Ba11gydF4y2Ba, 700-733(1990)。gydF4y2Ba
具有正确渐近行为的密度泛函交换能量近似。gydF4y2Ba理论物理。启一个gydF4y2Ba38gydF4y2Ba, 3098-3100 (1988)gydF4y2Ba
格里姆,埃利希,S. & Goerigk .色散校正密度泛函理论中阻尼函数的影响gydF4y2Baj .第一版。化学。gydF4y2Ba32gydF4y2Ba1456 - 1465(2011)。gydF4y2Ba
相关分子计算中使用的高斯基集。一、硼原子、氖原子和氢原子。gydF4y2Baj .化学。理论物理。gydF4y2Ba90gydF4y2Ba, 1007-1023(1989)。gydF4y2Ba
Weigend, F. Hartree-Fock交换H到Rn的拟合基集。gydF4y2Baj .第一版。化学。gydF4y2Ba29gydF4y2Ba, 167-175(2008)。gydF4y2Ba
Maier, J. A. et al. ff14SB:从ff99SB提高蛋白质侧链和骨架参数的准确性。gydF4y2Baj .化学。理论第一版。gydF4y2Ba11gydF4y2Ba, 3696-3713(2015)。gydF4y2Ba
乔根森,钱德拉塞卡,J.,马杜拉,J. D., Impey, R. W. & Klein, M. L.模拟液态水的简单势函数的比较。gydF4y2Baj .化学。理论物理。gydF4y2Ba79gydF4y2Ba, 926-935 (1983)gydF4y2Ba
Neese, F. ORCA程序系统。gydF4y2Ba电线第一版。摩尔。科学。gydF4y2Ba2gydF4y2Ba, 73-78(2012)。gydF4y2Ba
准:QM/MM方法的通用实现及其在催化问题中的应用。gydF4y2BaJ. Mol.结构。: THEOCHEMgydF4y2Ba632gydF4y2Ba, 1-28(2003)。gydF4y2Ba
Metz, S, Kästner, J., Sokol, A. A., Keal, T. W. & Sherwood, P. chemshell -用于QM / MM模拟的模块化软件包。gydF4y2Ba电线第一版。摩尔。科学。gydF4y2Ba4gydF4y2Ba, 101-110(2014)。gydF4y2Ba
Hättig, C.激发态结构优化与相关的二阶方法:CC2和ADC(2)。gydF4y2Ba量子化学。gydF4y2Ba50gydF4y2Ba, 37-60(2005)。gydF4y2Ba
Furche, F.等人。Turbomole。gydF4y2Ba电线第一版。摩尔。科学。gydF4y2Ba4gydF4y2Ba, 91-100(2014)。gydF4y2Ba
Rodriguez-Espigares, I.等人。GPCRmd揭示了3D-GPCRome的动力学。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 777-787(2020)。gydF4y2Ba
高尔斯,R.等。MDAnalysis:一个用于快速分析分子动力学模拟的Python包,gydF4y2Bahttps://conference.scipy.org/proceedings/scipy2016/oliver_beckstein.htmlgydF4y2Ba(2019)。gydF4y2Ba
michael - agrawal, N., Denning, E. J., Woolf, T. B. & Beckstein, O. MDAnalysis:用于分子动力学模拟分析的工具包。gydF4y2Baj .第一版。化学。gydF4y2Ba32gydF4y2Ba, 2319-2327(2011)。gydF4y2Ba
Aquila, A.等人。使用x射线自由电子激光的时间分辨蛋白质纳米晶体学。gydF4y2Ba选择快递。gydF4y2Ba20.gydF4y2Ba, 2706-2716(2012)。gydF4y2Ba
Gorel, A., Schlichting, I. & Barends, T. R. M.辨别非标准实验中基于xfell的生物晶体学标准的最佳实践。gydF4y2BaIUCrJgydF4y2Ba8gydF4y2Ba, 532-543(2021)。gydF4y2Ba
neuze, R., Wouts, R., van der Spoel, D., Weckert, E. & Hajdu, J.飞秒x射线脉冲生物分子成像的潜力。gydF4y2Ba自然gydF4y2Ba406gydF4y2Ba, 752-757(2000)。gydF4y2Ba
中山,T. A. & Khorana, H. G.在牛视紫红质中与视网膜发色团相互作用的膜嵌入螺旋中氨基酸的映射。gydF4y2Ba生物。化学。gydF4y2Ba266gydF4y2Ba, 4269-4275(1991)。gydF4y2Ba
Varma, N.等人。跳蛛视紫红质-1作为光敏GPCR的晶体结构。gydF4y2Ba国家科学院学报美国gydF4y2Ba116gydF4y2Ba, 14547-14556(2019)。gydF4y2Ba
确认gydF4y2Ba
该项目已根据Marie skodowska - curie资助协议701647 (M.J.R.), 701646 (S. Brünle)和884104 (PSI-FELLOW-III-3i;轮);瑞士国家科学基金会通过“Ambizione”资助PZ00P3_174169(给P.N.)和项目资助31003A_179351(给J.S.), 192780(给X.D.)和310030B_173335(给G.S.);并通过NCCR:MUST计划(给C.J.M.和J.S.)。F.P.通过国家研究分子超快科学和技术能力中心以及联邦理工学院飞秒和阿秒科学和技术计划对ETH Zürich表示感谢。该项目得到了日本科学振兴协会KAKENHI的资助。19 h05776;支持药物发现和生命科学研究的平台项目(支持创新药物发现和生命科学研究的基础(binding))JP21am0101070(给S.I.);国家科学中心(波兰)获批no.; 2017/27/B/ST2/01890 (to A.W.). R.N. acknowledges financial support from the Swedish Research Council (grant no. 2015-00560). We thank the members of the Engineering Team of RIKEN SPring-8 Center for technical support. XFEL experiments were conducted at BL3 of SACLA with the approval of the Japan Synchrotron Radiation Research Institute (proposal numbers 2015B8043 and 2018A8066). We acknowledge the staff at the SwissFEL and the Swiss Light Source synchrotron for excellent performance and support from the Alvra team and Macromolecular Crystallography group, respectively, during the beamtimes allocated for this study. The TR-XSS experiment was performed at the Linac Coherent Light Source (LCLS), SLAC National Accelerator Laboratory. Use of the LCLS is supported by the US Department of Energy, Office of Science, Office of Basic Energy Sciences under contract no. DE-AC02-76SF00515. Part of the sample injector used at LCLS for this research was funded by the National Institutes of Health, P41GM103393, formerly P41RR001209. We thank T. White and T. Nakane for advice regarding the use of the CrystFEL software and the SACLA processing pipeline, respectively; T. Maier for access to the SONICC imager used for finding the first rhodopsin crystal hits; the members of the High Performance Computing and Emerging Technologies Group at the Paul Scherrer Institute for technical support with the QM/MM simulations; C. Gati for initially helping to measure some rhodopsin crystals controls at the SONICC instrument (Hamburg); and G. Cicchetti for his comments on the paper.
资金gydF4y2Ba
Lib4RI - Library为ETH领域内的研究机构提供的开放获取资金:Eawag, Empa, PSI和WSL。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
该项目由G.S.发起,由R.N.提供意见,并由V.P.协调;G.S.负责协调和支持瑞士fel的晶体学应用,并在整个项目中参与讨论。S.I, E.N.和R.T.在SACLA分享经验,协调和支持晶体学应用。在LCLS和SACLA进行的XFEL初步试验分别得到了S. Boutet、k.t.、Y.J.和S.O的支持,J.S. Boutet在光束时间内准备了x射线仪器并收集了数据。利用T.G.、P.M.和V.P.对初始视紫红质晶体进行了实验,对高衍射晶体进行了优化,并对T.G.、P.S.和V.P.在瑞士光源下的衍射进行了测试。牛视网膜上的ROS膜用c.j. t.、V.P.和T.G.纯化,视紫红质用T.G.纯化和结晶,在光束时间前用a.f.、s.m.、c.j. t.、P.M.、j.m.、f.p.、n.v.进行了辅助支持。W.W.和V.P.在瑞士fel的Alvra终点站的泵浦探针实验由c.j.m.、p.j.m.j.、C.C.和D.J.完成;j.s.、R.N.和D.J.支持副总裁设定激光功率和数据采集方案。采用t.g.、N.V.和D.J.优化脂质样品注入,在XFEL的黑暗条件下,样品制备和储层加载采用t.g.、a.f.、s.m.、g.o.、d.k.、e.l.、H.G.和I.M.进行,粘性样品注入器在XFEL波束时间内分别采用g.g.、p.b.、d.g.、O.T.和a.w.以及D.J.和f.d.操作。终端站,包括激光系统,由p.j.m.j.、g.k.、c.c.、C.B.和c.j.m.校准和操作,他们还设计了Alvra prime泵浦探测站。SwissFEL的SFX数据分析管道由D.O.和K.N.建立和操作,波束时间内的数据处理由t.w.、P.N.和K.N.在D.O.、b.p.、d.k.、S. Brünle和C.M.C.的帮助下完成; D.K., X.D., C.M.C., A.F. and V.P. recorded progress during data collection. Data processing was further completed by T.W., T.G., K.N., M.J.R., A.D.D. and C.M.C. Crystal lattice translation was identified and corrected by M.J.R., C.M.C., V.P. and T.W. Structures were refined by T.G., M.J.R. and T.W., and data were interpreted by V.P with the help of X.D. and G.S. Quantum mechanics and molecular mechanics calculations were carried out by S.S. Molecular dynamics simulations were analysed by R.G.-G. The TR-XSS experiment was designed by R.N. and G.S. and analysed by D.S. and R.N. Additional scattering analyses were performed by V.K. The paper was written by V.P. with direct contributions from T.G., X.D., G.S. and R.N., and with further suggestions from the other authors. All of the authors read and acknowledged the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Massimo Olivucci和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1视紫红质分子晶体填充和晶格平移校正。gydF4y2Ba
a - c)。gydF4y2Ba视紫红质分子排列在空间群p2200的晶格中gydF4y2Ba1gydF4y2Ba2gydF4y2Ba1gydF4y2Ba.用脂质立方相法获得的牛视紫红质晶体揭示了典型的I型分子堆积,由2d晶体的有序堆叠组成gydF4y2Ba(一个)。gydF4y2Ba二维晶体通过视紫红质n端Asn2和Asn15的糖基相互接触,在c维上产生头对头的晶体接触。gydF4y2Ba(b)。gydF4y2Ba潜在生理二聚体的观点gydF4y2Ba35gydF4y2Ba分别与两个视紫红质分子的跨膜结构域1(蓝色部分)接触。gydF4y2Ba(c)。gydF4y2Ba分子排列的俯视图。“光谱”彩虹颜色逐渐从TM1(蓝色)转变为TM7(红色)和两类螺旋(8)。gydF4y2Bad - i)gydF4y2Ba晶格平移校正。尽管有简单的分子替代(Phaser MR, PhenixgydF4y2Ba75gydF4y2Ba,请参阅gydF4y2Ba方法gydF4y2Ba)和含有p22的溶液gydF4y2Ba1gydF4y2Ba2gydF4y2Ba1gydF4y2Ba暗视紫红质数据分析表明Patterson函数中存在多个非原点峰gydF4y2Ba36gydF4y2Ba.特别是,td = (0,0.245,0)(SwissFEL)和(0,0.243,0)(SACLA)处的Patterson峰被归因于晶体中存在两个平移相关畴。据此,鬼影密度被确定为(gydF4y2BadgydF4y2Ba在Fo-Fc图(绿色和红色,等高线为3.83 rmsd)中,部分重叠于构建视紫红质模型的2Fo-Fc图(蓝色,2.7 rmsd)。gydF4y2Bae)gydF4y2Ba校正单畴x射线强度后gydF4y2Ba36gydF4y2Ba根据Wang等人。gydF4y2Ba72gydF4y2Ba(见gydF4y2Ba方法gydF4y2Ba),整体视紫红质电子密度图2Fo-Fc显示较少的鬼电子密度(绿色和红色)。更局部的在一些受影响的氨基酸残基位置,例如比较P34的电子密度gydF4y2Ba(1.29)gydF4y2Ba/A在下面板gydF4y2Ba(g)gydF4y2Ba(更正)上gydF4y2Ba(f)gydF4y2Ba(最初的)。gydF4y2Ba设定h)gydF4y2Ba重要的是,视紫红质的视网膜结合袋不受密度重叠和校正以及校正后的密度的影响gydF4y2Ba(我)gydF4y2Ba与原始数据相比,差异图只显示了微小的变化gydF4y2Ba(h)gydF4y2Ba.gydF4y2Ba
扩展数据图2时间分辨序列飞秒晶体学。gydF4y2Ba
时间分辨飞秒晶体学(TR-SFX)gydF4y2Ba101gydF4y2Ba是用x射线自由电子激光进行的gydF4y2Ba102gydF4y2Ba.晶体板(20µm大,约1.5µm厚)由从牛视网膜(gydF4y2Ba答:面板gydF4y2Ba,比例尺为20µm)。样本被放大(gydF4y2Bab .面板gydF4y2Ba,比例尺为20 μ m),并进行泵浦和探针实验(gydF4y2Bac .面板gydF4y2Ba)由480 nm光激活(泵浦激光)触发。简单地说,在黑暗中生长在脂质立方相(LCP)中的视紫红质晶体在泵浦激光器的光下被连续注入(粘性射流),并在各种时滞(∆gydF4y2BatgydF4y2Ba从1到100皮秒)使用来自SACLA(日本)(蓝色双星号)或SwissFEL(瑞士)(紫色星号)的x射线自由电子激光器(在“衍射-销毁”制度下)gydF4y2Ba103gydF4y2Ba.在SwissFEL上进行10 ps延时,激光设置如下:泵浦激光,483 nm, 3 μ J/100fs脉冲,84 μ m FWHM和一个12 keV, 25 fs脉冲长度的XFEL,聚焦3 x 5 μ m。这个过程可以在飞行中完成,也可以在家里使用CrystFEL软件完成gydF4y2Ba69gydF4y2Ba将每个晶体产生的30 000个衍射图案组合成一个数据集。的插入gydF4y2Bab .面板gydF4y2Ba说明了大量产生视紫红质晶体时晶体周围脂质相的不透明性,阻碍了TR-SFX样品的光谱实验。gydF4y2Ba
图3泵浦激光的功率密度与时间分辨x射线溶液散射(TR-XSS)的水加热信号或时间分辨序列飞秒晶体学的视紫红质光产物外观之间的相关性。gydF4y2Ba
a e)。gydF4y2Ba在目前的实验设置中,用于观察视紫红质中体面的差分电子密度(DED)信号的泵浦激光功率的最低限度(a-e)。在2种不同的激光功率下,收集两组10 ps时间延迟光激活的视紫红质数据集(SwissFEL beamtime 20200597), 1.5 (gydF4y2BaA和cgydF4y2Ba)和3µJ/100 fs脉冲(gydF4y2BaB和dgydF4y2Ba),具有相同焦点(100µm光斑直径(1/egydF4y2Ba2gydF4y2Ba))和相同数量的29.900张图像。对于两种泵浦激光功率,视网膜异构化和伴随的c20 -甲基旋转都是可见的,但在低功率设置的情况下,几乎检测不到正电子密度信号(gydF4y2BaA面板与b面板的比较gydF4y2Ba),例如,11-顺式到反式的反应以11-顺式上有很强的负电子密度为标志,但没有检测到相应的正电子密度。当两者的DED强度都增加到0.100 e/Å的相等水平时gydF4y2Ba3 gydF4y2Ba,我们观察到低泵浦激光能量条件下的信噪比(gydF4y2Bac面板gydF4y2Ba)的能量如此之低,以至于信号无法被解释,与两倍能量的情况相比(gydF4y2Bad小组gydF4y2Ba).功率滴定包括1.5µJ/100 fs脉冲、3µJ/100 fs脉冲(10 ps时间点)和5µJ/100 fs脉冲(1 ps时间点),峰值功率密度为382 GW/cmgydF4y2Ba2gydF4y2Ba, 764 GW/cmgydF4y2Ba2gydF4y2Ba1914 GW/cmgydF4y2Ba2gydF4y2Ba,分别(gydF4y2Bae小组gydF4y2Ba).gydF4y2Ba(f-h)gydF4y2Ba使用XFEL辐射的时间分辨x射线溶液散射(TR-XSS)视觉视紫红质研究。gydF4y2Baf)gydF4y2Ba在不同激光功率密度下,洗涤剂溶解的视紫红质样品在LCLS上所记录的TR-XSS差值(激光开启-激光关闭)为10ps≤Δt≤1 μs。gydF4y2Bag)gydF4y2Ba主奇异值分解(SVD)成分(蓝线)来自视觉视紫红质样品,指示激光诱导加热(特征曲线从0.5 ÅgydF4y2Ba−1gydF4y2Ba≤q≤2.5 ÅgydF4y2Ba−1gydF4y2Ba)以及通常与蛋白质诱导的结构变化相关的振荡(从0.25可见ÅgydF4y2Ba−1gydF4y2Ba≤q≤1.0 ÅgydF4y2Ba−1gydF4y2Ba).利用同步辐射从一个光合反应中心的洗涤剂溶解样品中记录的单独加热引起的实验差异x射线散射曲线(红线)gydF4y2Ba65gydF4y2Ba,用于校准该激光诱导加热。gydF4y2BahgydF4y2Ba)在480 nm fs激光脉冲下,通量为110 mJ/cm, TR-XSS测量视紫红质样品的激光诱导加热gydF4y2Ba2gydF4y2Ba(独立测量次数,n = 6);400 mJ /厘米gydF4y2Ba2gydF4y2Ba(n = 6);830 mJ /厘米gydF4y2Ba2gydF4y2Ba(n = 3);1640 mJ/cmgydF4y2Ba2gydF4y2Ba(n = 2),其中通量是激光光斑FWHM上的平均值。负延时(n = 4)作为对照(在零通量时绘制)。数据以平均值+/−SEM表示。gydF4y2Ba
图4视紫红质光激活1、10和100 ps三种时滞下观测和计算的电子密度差图的比较,显示精细模型(右图)与原始电子密度差数据(左图)很好地吻合。gydF4y2Ba
差分傅立叶电子密度图直接由初始实验电子密度图(Fobs(浅色)-Fobs(深色))创建。gydF4y2Ba(左面板)gydF4y2Ba或由计算出的原子结构模型因子(Fcalc(浅色)-Fcalc(深色))gydF4y2Ba(右面板)gydF4y2Ba并对1ps数据集进行比较gydF4y2Ba(a vs b;G对h)gydF4y2Ba, 10psgydF4y2Ba(c对d)gydF4y2Ba, 100 ps数据集gydF4y2Ba(e对f)gydF4y2Ba.面板显示了视紫红质在黑暗状态下的视网膜结合袋(gydF4y2Ba所有面板gydF4y2Ba)(或与1ps光活化结构叠加gydF4y2Ba(gf)gydF4y2Ba),视网膜为红色(黄色为1ps结构)gydF4y2Ba(gf)gydF4y2Ba),用2Fobs-Fcalc电子密度图等高线(灰色网格)gydF4y2Ba(f)gydF4y2Ba.用颜色突出显示,光激活的和深色视紫红质的傅立叶电子密度信号之间的差异显示随时间出现的特征,蓝色(正密度)与金色(负密度)中消失的特征相关。在不同rmsd值下的网格等高线进行了调整,以方便不同类型的地图的左右比较和图形的清晰度(参见面板中的值)gydF4y2Baa -gydF4y2Ba).gydF4y2Ba
图5视紫红质各向异性呼吸运动。gydF4y2Ba
光激活1、10和100皮秒时视紫红质整体构象变化的比较。来自1ps光照视紫红质数据集叠加在视紫红质暗态结构模型(灰色)上的差分电子密度图(Fobs(1ps-light)-Fobs(dark)轮廓为4.2 rmsd) (gydF4y2Baa - bgydF4y2Ba)显示强信号(蓝色=正密度;黄色=负密度)的视网膜分子(红色)显示早期异构化。在视网膜周围,氨基酸水平的变化以各向异性的方向向细胞外一侧(灰色箭头)发生gydF4y2Ba板一个gydF4y2Ba)沿TM5及TM6 (gydF4y2Ba面板f和ggydF4y2Ba).这种各向异性的呼吸运动可在TM3的细胞外部分检测到(gydF4y2BaegydF4y2Ba), tm5 (gydF4y2BafgydF4y2Ba)及TM6 (gydF4y2BaggydF4y2Ba).10ps后(gydF4y2Ba面板hgydF4y2Ba)及100 ps (gydF4y2Ba板我gydF4y2Ba)的光激活,大部分构象协调运动的改变被复位(gydF4y2BaH, I和gydF4y2Ba扩展数据表gydF4y2Ba3 gydF4y2Ba),只有少数氨基酸不会还原,如二硫化物桥C110-C187(粉红色箭头),并参与光激活途径的进一步变化(扩展数据表)gydF4y2Ba3 gydF4y2Ba).有趣的是,我们还观察到从GPCRmd数据库分析的暗态(PDBid: 1GZM)视紫红质分子动力学模拟的局部内禀波动gydF4y2Ba98gydF4y2Ba.这些波动定位于跨膜束的细胞外侧,并与1 ps时观察到的能量耗散变化相一致(比较gydF4y2Ba面板c和d(分子动力学模拟),面板a和b(呼吸运动)gydF4y2Ba).分析了视紫红质与视网膜(PDBid: 1GZM)的三个独立分子动力学模拟(3 x 2500帧),并在每个残基上描绘了从白色到红色的主干均方根波动(RMSF刻度被截断在1.8 Å以便清晰)。gydF4y2Ba
图6 TR-SFX光激活视紫红质1,10和100 ps后的视网膜构象,希夫碱环境。gydF4y2Ba
(f)gydF4y2Ba视网膜构象改变直到100 ps。gydF4y2Ba一)gydF4y2Ba视网膜TR-SFX模型在黑暗中的叠加(红色模型)和1到100 ps的光激活时间延迟突出了主要的差异:C11-C12的顺式-反式异构化和c20 -甲基在C13周围的伴随旋转。除了β-ionone环的轻微倾斜,1(黄色模型),10(浅蓝色)和100(绿色)ps-结构之间的另一个差异是多烯链向平面的轻微松弛。gydF4y2Bab)gydF4y2BaSFX获得的视紫红质暗态视网膜周围的原始电子密度图(2.5 rmsd等高线的2Fo-Fc图)和由此产生的精制模型为红色。gydF4y2Bac)gydF4y2BaTR-SFX获得的1 ps光激活视紫红质视网膜周围的外推电子密度图(2ffx - fc图等高线为1.9 rmsd)和由此产生的精制模型为黄色。gydF4y2Bad)gydF4y2Ba通过TR-SFX得到的10ps光激活视紫红质视网膜周围的外推电子密度图(2fect - fc图等高线为0.9 rmsd)和得到的精细模型为蓝色。gydF4y2Bae)gydF4y2Ba通过TR-SFX得到的100 ps光激活视紫红质视网膜周围的外推电子密度图(2fect - fc图等高线为1.9 rmsd)和得到的精制模型为绿色。gydF4y2Baf)gydF4y2Ba通过TR-SFX(本研究)获得的1ps光激活后的视紫红质结构(黄色模型),与低温捕获的视紫红质状态(绿色模型)和暗状态(红色模型)相比。gydF4y2Ba(g-h)gydF4y2Ba在1皮秒的光活化后,席夫碱对离子E113和邻近的水氢键网络。gydF4y2Ba面板ggydF4y2Ba: C11-C12异构化对希夫碱构象和到反离子E113的距离的影响。视紫红质的两个模型叠加在蛋白质的Cɑ原子上。光激活1 ps后的视网膜(黄色(橙色K296gydF4y2Ba(7.43)gydF4y2Ba)显示全反式构象,与暗态结构(红色)相比,SB上C14-C15-NZ平面的C15向细胞外空间显示轻微的踢动。反离子E113gydF4y2Ba(3.28)gydF4y2Ba相应移动,在同一方向约0.2-0.3 Å。gydF4y2Ba面板hgydF4y2Ba:两个水分子W03和W04在反离子E113之间形成一个桥gydF4y2Ba(3.28)gydF4y2Ba和M86gydF4y2Ba(2.53)gydF4y2Ba(同时联系A117gydF4y2Ba(3.32)gydF4y2Ba, F91gydF4y2Ba(2.58)gydF4y2Ba和F116gydF4y2Ba(3.31)gydF4y2Ba(未显示),只有W04获得了订单。两个视紫红质分子模型(深红色部分;1 ps(黄色)的等高线与各自的电子密度图,蓝色(2Fo-Fc等高线在1.3 rmsd)和橙色(2fextrapolat - fc等高线在1.3 rmsd)。由ΔgydF4y2BatgydF4y2Ba= 100秒时,我们观察到一个重置的占用,这是类似于黑暗状态结构。gydF4y2Ba
图7光激活0、1、10和100 ps时视网膜与其结合袋的相互作用以及与微生物视紫红质的比较。gydF4y2Ba
LIGPLOTgydF4y2Ba58gydF4y2Ba视紫红质结合位点内视网膜相互作用的观点gydF4y2Ba(上面四幅)gydF4y2Ba(设置距离< 3.6 Å)在不同的光激活延迟、暗态、1,10和100ps光激活状态下。橙色标记的氨基酸和原子间相互作用虚线是发生重大变化的位置,表示新的相互作用,例如与水W01或与C187失去接触gydF4y2Ba(ECL2)gydF4y2Ba.非同源视紫红质视网膜结合袋gydF4y2Ba(下方四幅)gydF4y2Ba(PDBid编码以粗体显示)来自哺乳动物(来自牛牛的视紫红质GPCR(本研究)(PDBid=gydF4y2Ba7 zbegydF4y2Ba)和原核生物(Halobacterium salinarum的菌视紫红质质子泵(PDBid=gydF4y2Ba6 g7hgydF4y2Ba);KR2钠泵gydF4y2BaKrokinobacter eikastusgydF4y2Ba(PDBid =gydF4y2Ba6 tk7gydF4y2Ba)和NmHR氯化物泵gydF4y2BaNonlabens绿gydF4y2Ba(PDBid =gydF4y2Ba7 o8fgydF4y2Ba))。第三个跨膜螺旋(GPCRs中的“TM3”和原核生物中的“螺旋C”)已被描述为视网膜的主要相互作用位点gydF4y2Ba104gydF4y2Ba,通常携带稳定的反离子,如视紫红质中的E113。根据这四种视紫红质的暗态结构,视网膜异构化过程中一些重要的结构重排(gydF4y2Ba独联体gydF4y2Ba- - - - - - - - -gydF4y2Ba反式gydF4y2Ba对于哺乳动物视紫红质,gydF4y2Ba反式gydF4y2Ba- - - - - - - - -gydF4y2Ba独联体gydF4y2Ba对于原核视紫红质),在TR-SFX研究中观察到的皮秒范围内,用红色箭头表示。这些重要相互作用的中断削弱了TM3/螺旋C对视网膜发色团的稳定。gydF4y2Ba
补充信息gydF4y2Ba
补充视频1gydF4y2Ba
视紫红质光激活0 ps、1 ps和100 ps后视网膜结合袋的延时GIF图像。三种模式的视紫红质在黑暗(红色)和1 ps(黄色)和100 ps(绿色)光激活叠加。该视频显示了这些模型的视网膜结合袋的延时动图,先后与深色(2gydF4y2BaFgydF4y2BaogydF4y2Ba−gydF4y2BaFgydF4y2BacgydF4y2Ba),然后是1ps (2gydF4y2BaFgydF4y2BaextgydF4y2Ba−gydF4y2BaFgydF4y2BacgydF4y2Ba),然后100ps (2gydF4y2BaFgydF4y2BaextgydF4y2Ba−gydF4y2BaFgydF4y2BacgydF4y2Ba)地图。许多弱相互作用显示为虚线,黄色箭头指向变化最大的区域。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
格鲁尔,T,韦纳特,T,罗德里格斯,M.J.gydF4y2Baet al。gydF4y2Ba超快的结构变化指导视觉的第一个分子事件。gydF4y2Ba自然gydF4y2Ba(2023)。https://doi.org/10.1038/s41586-023-05863-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-023-05863-6gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba