文摘gydF4y2Ba
翻译调控哺乳动物早期胚胎发育是至关重要的gydF4y2Ba1gydF4y2Ba。然而,先前的研究一直局限于批量测量gydF4y2Ba2gydF4y2Ba,这样就无法准确翻译监管包括allele-specific测定分析。应对这一挑战,我们开发了一种新型微流控等速电泳(ITP)方法,名为核糖体通过ITP (Ribo-ITP),分析和特征翻译在单卵母细胞和胚胎小鼠的早期发展。我们确定了微分翻译效率作为关键机制参与中心体组织和调节基因gydF4y2BaNgydF4y2Ba6gydF4y2Ba-methyladenosine rna的修改。我们高覆盖率测量启用,据我们所知,第一个allele-specific核糖体参与早期发展的分析。这些导致受精卵的stage-specific微分订婚的发现与核糖体rna和减少翻译成绩单展示allele-biased效率表达式。通过与蛋白质组学数据集成我们的测量,我们发现在胚胞阶段卵母细胞核糖体入住率是受精卵的蛋白质丰度的主要决定因素。Ribo-ITP方法将使众多应用程序通过提供高覆盖率和高分辨率核糖体入住率测量从超低输入样本包括单个细胞。gydF4y2Ba
主要gydF4y2Ba
早期基因表达景观是由转录后调控的孕产妇记录由于缺乏转录从后期卵母细胞成熟的早期分化的胚胎gydF4y2Ba3gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。因此,RNA和蛋白质表达丰度太多关联直到桑椹胚阶段,强调需要阐明转录后调控胚胎发育在初始阶段gydF4y2Ba1gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba。特别是,平移控制特定的记录对卵母细胞成熟和oocyte-to-embryo过渡至关重要gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba。gydF4y2Ba
Transcriptome-wide mRNA翻译可以测量的高通量测序的核糖体RNA片段保护核酸酶消化gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba。然而,传统的核糖体分析方法涉及多个步骤与实质性损失的输入材料,限制其应用和大量的细胞样本。因此,许多重要的问题与平移控制仍然需要解决由于有限的可用性生物材料。gydF4y2Ba
为了克服这个限制,我们开发了一种方法利用微流控芯片上的ITP的原则为核糖体的隔离保护片段(rpf)。ITP曾被申请提取核酸的血液、尿液和细胞培养样本gydF4y2Ba11gydF4y2Ba。与传统的RNA提取方法相比,国际旅游业伙伴关系提供了更快的处理时间,没有要求的液体转移RNA输入和高收益低gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba。尽管有这些优势,国际旅游业伙伴关系被认为没有能力提供应用程序所需的严格的大小选择,如核糖体剖析gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba。gydF4y2Ba
Ribo-ITPgydF4y2Ba
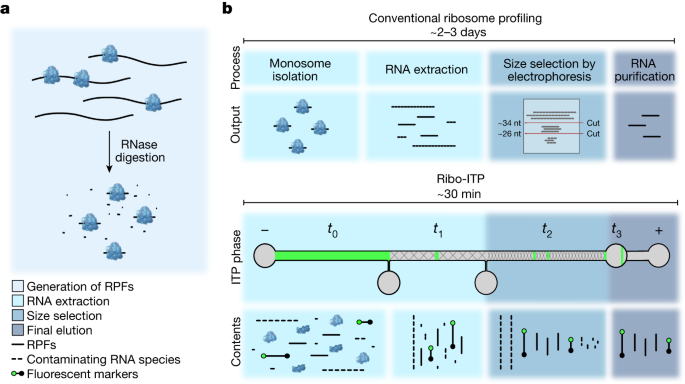
这里我们设计和制造定制的微流体聚二甲基硅氧烷(PDMS)芯片恢复核糖体的足迹从nuclease-digested溶解产物使用一种名叫Ribo-ITP的专业技术与高收益(无花果。gydF4y2Ba1 a, bgydF4y2Ba,扩展数据图。gydF4y2Ba1 a, bgydF4y2Ba和补充视频gydF4y2Ba1gydF4y2Ba)。我们实现了众多创新,使化学要求实现单细胞核糖体ITP的耦合分析的一个优化片上大小选择。具体来说,我们利用预处理通道与苯甲酮使光致聚合的聚丙烯酰胺在PDMS芯片gydF4y2Ba16gydF4y2Ba。帮助可视化,我们包括DNA寡核苷酸标记包含一个5′荧光团和3′dideoxycytosine (ddC)修改防止标记放大在下游图书馆准备(扩展数据图。gydF4y2Ba1 cgydF4y2Ba)。芯片上的缓冲区交换允许纯化rna直接兼容3′去磷酸化,测序图书馆的第一步准备rpf(扩展数据图。gydF4y2Ba1 dgydF4y2Ba)。最后,我们采用一种有效的单筒库制备化学,依赖于一个模板切换逆转录酶和公司独特的分子指标rpf的5′末端。集体,Ribo-ITP降低样品需求,许多数量级,同时减少样品处理时间交付核糖体入住率测量从超低输入样本,包括单个细胞。的详细协议包括视频指令描述Ribo-ITP方法可能被访问gydF4y2Bahttps://ceniklab.github.io/ribo_itpgydF4y2Ba。gydF4y2Ba
一个gydF4y2Ba,代rpf的示意图。核糖核酸酶消化后,rpf孤立与传统或Ribo-ITP方法。gydF4y2BabgydF4y2Ba,传统的核糖体的示意图分析协议和提取rpf的Ribo-ITP过程。在Ribo-ITP,标记寡核苷酸5′荧光团(绿色圆圈)和3′ddC阻塞修改(黑圈),封装rpf的大小范围,被添加到消化细胞溶解产物。溶菌产物内容加载到通道(gydF4y2BatgydF4y2Ba0gydF4y2Ba),那么电流应用于一种选择性地关注一个特定的电泳淌度范围,使核酸提取国际旅游业伙伴关系。核酸提取在一个狭窄的ITP乐队,然后大小选为他们迁移到5% (gydF4y2BatgydF4y2Ba1gydF4y2Ba)和10% (gydF4y2BatgydF4y2Ba2gydF4y2Ba分别)聚丙烯酰胺凝胶。在运行结束时,净化和收集size-selected rna (gydF4y2BatgydF4y2Ba3gydF4y2Ba)。gydF4y2Ba
Ribo-ITP RNA提取和大小选择gydF4y2Ba
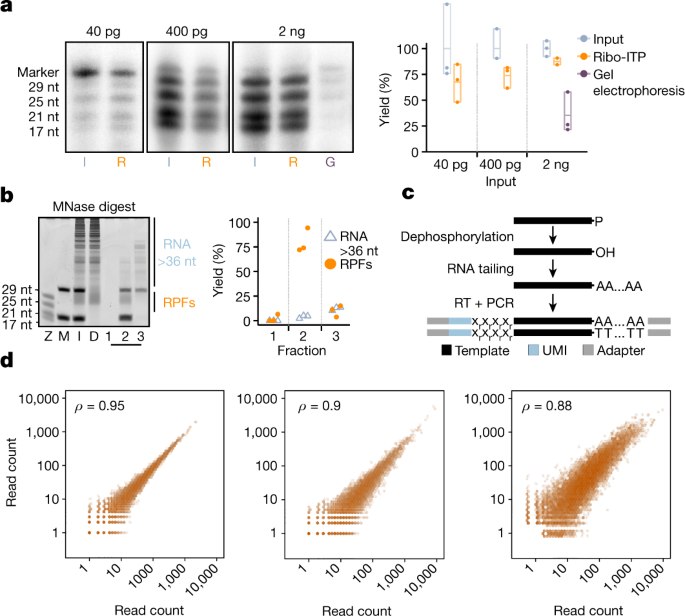
考虑到一个典型的哺乳动物细胞包含大约10-40 pg的RNA,这样的方法能产生核糖体的入住率测量限制金额需要保持持续高产的RPF复苏与沙克的输入范围。我们首先比较了复苏的rna跨rpf的典型尺寸范围(大约21-35核苷酸(nt))通过传统的凝胶与Ribo-ITP采用方法。当使用20 ng输入样本,Ribo-ITP产生94±3.5% (s.e.m)复苏相比只有38±10.9%传统凝胶萃取方法(扩展数据图。gydF4y2Ba1 e, fgydF4y2Ba)。然后我们采用了放射性标签分析可视化和量化的复苏超低RNA输入(40 pg 2 ng)。2 ng RNA输入,87.5±3.2%的收益率是通过Ribo-ITP与传统凝胶萃取(图35.3±11.4%。gydF4y2Ba2gydF4y2Ba)。当RNA输入400 pg和40宝洁的进一步下降,经济复苏Ribo-ITP仍高达74±6.1%和67.5±10.6%,分别(无花果。gydF4y2Ba2gydF4y2Ba)。凝胶萃取与这些样本有微不足道的收益。因此,持续高用Ribo-ITP RNA证明这种方法使高收益提取即使在超低输入。gydF4y2Ba
一个gydF4y2Ba,代表凝胶图像强调输入(I), rna恢复了Ribo-ITP (R)和凝胶电泳(G)(左)所示。四种rna的17日,21日,25和29元(Z)试验中使用放射性同位素5′末端。25元每分产量计算的RNA(右)。gydF4y2BabgydF4y2Ba,代表凝胶图像的大小选择实验(gydF4y2BangydF4y2Ba从两个独立的实验= 3)。MNase-digested RNA的K562细胞(D), 100 ng作为输入(I)用于Ribo-ITP后添加两个荧光标记寡核苷酸(M)。在一个典型的实验中,我们收集了样本两侧的两个荧光标记核苷酸(分数2)。在这里,我们也收集了RNA的到来之前,筛选了较短的荧光标记(第1部分)以及位于后面的RNA荧光标记(第3部分)的时间越长,通常留在通道。rna的每分钱收益率大于长荧光标记寡核苷酸(超过约36元)(蓝色)和rna两侧标记(橙色),对应于rpf的尺寸范围,绘制每个分数。gydF4y2BacgydF4y2Ba,测序图书馆准备协议的示意图。在单管反应,孤立的rpf 3′脱去磷酸和聚(a)跟踪。template-switching逆转录酶(RT)创建模板,结合独特的分子index-containing适配器。gydF4y2BadgydF4y2Ba两两相关的能够核糖体入住率以传统人类K562细胞中的核糖体剖析和Ribo-ITP情节(右)。左边情节突出两种传统复制从大约1000万个细胞核糖体分析实验。中间的情节是由两个复制的Ribo-ITP大约100个细胞。的情节,我们使用平均为每个基因计数每百万读取次数。之间的斯皮尔曼相关系数能够核糖体入住率左上角所示。gydF4y2Ba
分析的效率,我们的方法排除RNA片段比rpf(超过36元),我们消化总RNA从人类骨髓性白血病细胞株(K562)和微球菌的核酸酶(MNase),纯化样品并实施Ribo-ITP(无花果。gydF4y2Ba2 bgydF4y2Ba)。我们取得了94%的排除不必要的大RNA片段(超过36元)(图gydF4y2Ba2 bgydF4y2Ba)。最后,为了验证的能力Ribo-ITP从复杂的细胞溶解产物中提取rna,我们飙升RPF-sized合成rna(17日21日25和29元)到总从大约1000 K562细胞细胞溶解产物。Ribo-ITP这个样例恢复上升rna与严格的大小选择和高收益(扩展数据图。gydF4y2Ba1 g hgydF4y2Ba)。总的来说,这些结果表明,Ribo-ITP可以同时提取和大小选择RPF-size rna与高产细胞溶解产物。gydF4y2Ba
Ribo-ITP单细胞核糖体入住率gydF4y2Ba
验证核糖体的质量分析数据,我们执行Ribo-ITP从100年单身,K562细胞核糖体以及传统分析使用标准的单体分离方法gydF4y2Ba17gydF4y2Ba从1000万年K562细胞(图。gydF4y2Ba2摄氏度gydF4y2Ba)。从100个细胞核糖体入住率测量获得使用Ribo-ITP高度重现在复制(无花果。gydF4y2Ba二维gydF4y2Ba,扩展数据图。gydF4y2Ba2 a, bgydF4y2Ba和补充表gydF4y2Ba1gydF4y2Ba)。显示的足迹充实在注释翻译启动和停止网站(扩展数据图。gydF4y2Ba2 c, dgydF4y2Ba)。大多数记录映射读取起源于编码序列(CDS)并显示3 nt是高纯度的周期性分布期望从随机分裂(卡方测试,gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba;扩展的数据图。gydF4y2Ba2 e, fgydF4y2Ba)。至关重要的是,从100个细胞核糖体分析测量由Ribo-ITP重现了传统核糖体分析测量(斯皮尔曼相关系数为0.88;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba;无花果。gydF4y2Ba二维gydF4y2Ba)。这些结果表明,核糖体入住率可以准确地测量从100年只有使用Ribo-ITP人类细胞。gydF4y2Ba
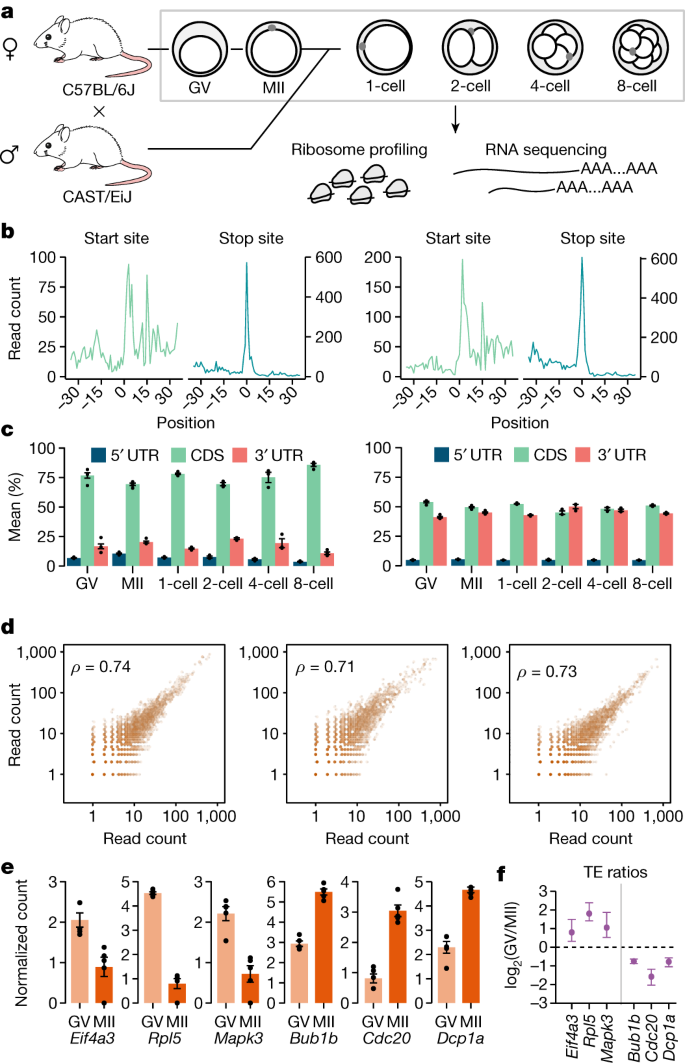
接下来,我们应用Ribo-ITP和RNA序列(RNA-seq)来描述翻译单个卵母细胞在胚泡的变化和中期II (MII)阶段,单从一个细胞的胚胎小鼠受精卵到八细胞阶段(无花果。gydF4y2Ba3gydF4y2Ba和补充表gydF4y2Ba1gydF4y2Ba)。特别是,受精卵的初始分裂发生在缺乏新的RNA合成,呈现存储孕产妇成绩单的翻译绝对有必要开发的早期阶段。gydF4y2Ba
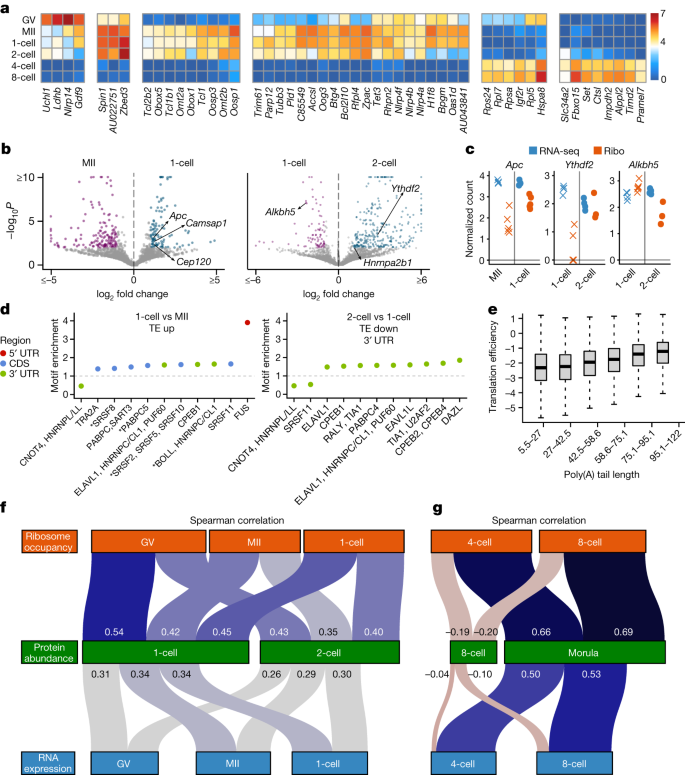
一个gydF4y2Ba,老鼠实验的示意图。未孕卵母细胞(胚泡(问)和信息产业部阶段)的C57BL / 6 j应变沿与eight-cell-stage受精卵胚胎的杂交两种(C57BL / 6 j和演员/ EiJ)收集核糖体RNA表达和入住率测量。gydF4y2BabgydF4y2Ba,核糖体入住率翻译启动和停止网站代表受精卵(一个细胞;左)和一个eight-cell-stage胚胎(右)。翻译开始(或停止)网站用位置0。聚合读计数(gydF4y2BaygydF4y2Ba轴)相对于启动(或停止)网站策划网站后校正(方法)。gydF4y2BacgydF4y2Ba读取文本区域的分布(5′UTR、cd和3′UTR)(左)所示。这些区域的长度分布的加权的核糖体入住率也描绘(右)。误差线表示平均数标准误差百分比。gydF4y2BadgydF4y2Ba两两相关的能够在单个细胞核糖体入住率(问老鼠卵母细胞(左),信息产业部小鼠卵母细胞(中间)和一个细胞小鼠胚胎(右)与斯皮尔曼相关系数一起策划(左上角)。gydF4y2BaegydF4y2Ba的均值和标准误差集中日志核糖体入住率的比率(gydF4y2BaygydF4y2Ba轴)策划了代表成绩单,以前在GV-stage增加了多核糖体协会(gydF4y2BaegydF4y2Ba)或MII-stage (gydF4y2BafgydF4y2Ba)卵母细胞gydF4y2Ba18gydF4y2Ba(剩下的基因补充图所示。gydF4y2Ba12gydF4y2Ba)。gydF4y2BafgydF4y2Ba,翻译效率计算除以核糖体RNA表达入住率的胚胞阶段和MII-stage卵母细胞。所选记录,日志翻译效率比这两个阶段之间绘制的平均数标准误差在复制。gydF4y2Ba
在我们的单细胞核糖体占用数据,胚泡,信息产业部和一个细胞我们观察到的来自48017个不同的分子中位数编码区域记录,导致平均5064个基因细胞的检测(范围4076 - 6679;扩展的数据图。gydF4y2Ba3 a, bgydF4y2Ba)。Single-oocyte和单个胚胎核糖体分析数据显示预期的足迹浓缩映射编码区域和特征不仅在启动和停止网站(无花果。gydF4y2Ba3 b, cgydF4y2Ba和扩展数据图。gydF4y2Ba3 c, dgydF4y2Ba)。复制的测量核糖体入住率是高度相关(图。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba3 egydF4y2Ba)。gydF4y2Ba
来验证我们的单细胞核糖体的质量分析测量,我们比较我们的结果之前的研究,收集了大约500 - 600胚胞阶段和MII-stage卵母细胞和验证变化多核糖体与定量一实验29成绩单gydF4y2Ba18gydF4y2Ba。我们的单细胞核糖体分析测量结果重现了先前确定的变化核糖体协会28 29 rna(无花果。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba)。在一起,我们的研究结果表明,Ribo-ITP使高度一致的和高质量的核糖体入住率测量单个细胞和单个胚胎小鼠早期发育期间。gydF4y2Ba
Ribo-ITP allele-specific翻译gydF4y2Ba
在鼠标开发中,目前我们不知道何时zygotically合成rna参与核糖体和是否存在gene-specific allele-specific这些动力学的差异。我们首先解决allele-specific合子基因组激活后表达的问题。确定性和随机等位基因的差异表达比率被认为有助于分化和正常发展,尽管研究仅限于表观遗传学和转录水平在小鼠早期胚胎gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba。gydF4y2Ba
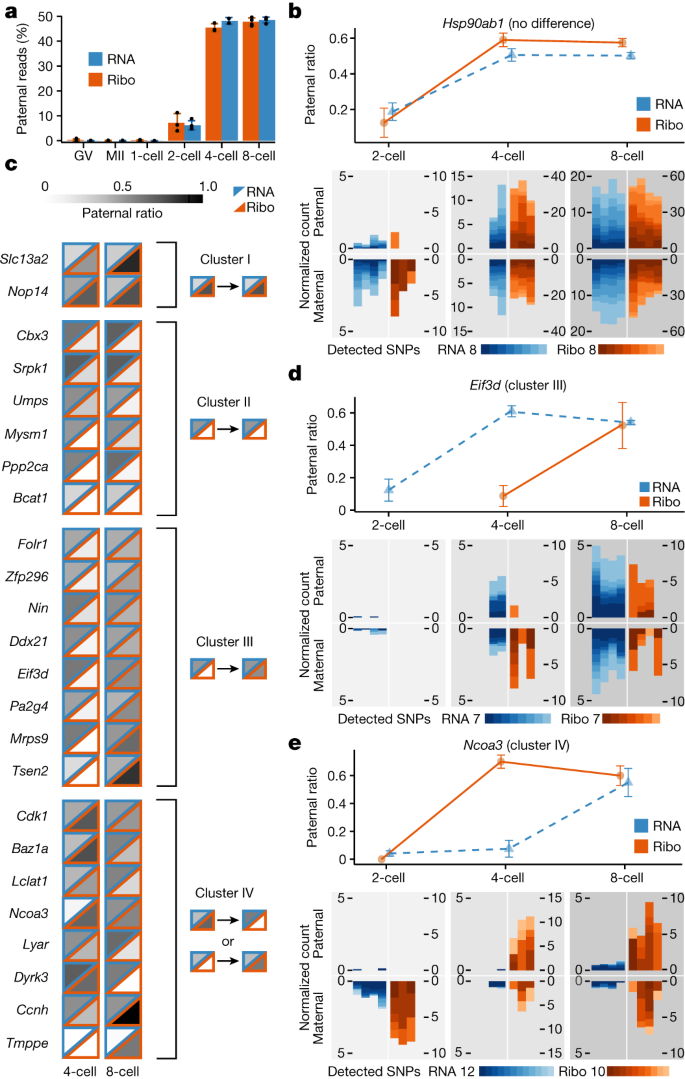
区分RNA分子来自父系和母系等位基因,我们从两个鼠标的交叉分析胚胎菌株(C57BL / 6 j×投/ EiJ)。使用毒株特异性单核苷酸多态性(snp)区分父系和母系rna,我们发现229991独特parent-of-origin-specific rpf映射编码区域(方法)。gydF4y2Ba
监控allele-specific核糖体订婚与相应的RNA表达gydF4y2Ba21gydF4y2Ba,我们主要集中在父亲的等位基因,与RNA的起源,是新合成的代理记录(方法)。我们分析了全球核糖体的结果关系的模式派生的rna,也就是说,父亲的等位基因比率,通过聚合读取所有检测到的基因。我们发现,与合子的转录的激活,核糖体入住率的父亲的比率稳步增加的7.1% two-cell-stage eight-cell-stage胚胎47.7%胚胎(无花果。gydF4y2Ba4gydF4y2Ba和扩展数据图。gydF4y2Ba5 a、bgydF4y2Ba)。我们发现父亲的等位基因的比例在这些阶段之间统计上无法区分核糖体入住率和RNA表达(gydF4y2BatgydF4y2Ba以及;gydF4y2BaPgydF4y2Ba为所有阶段> 0.14;无花果。gydF4y2Ba4gydF4y2Ba)。这个结果表明,核糖体订婚是整体并发通过合子基因组激活与父亲的rna的合成。gydF4y2Ba
一个gydF4y2Ba毒株特异性snp被用来分配顺序读取,父亲和母亲的等位基因(方法)。的均值和标准误差的比例的读入每个阶段(gydF4y2BaygydF4y2Ba绘制轴)。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba、线情节(上)显示的百分比的读取(gydF4y2BaygydF4y2Ba轴)在RNA-seq和Ribo-ITP实验。读相结合在复制,误差的平均数标准误差表示的比率。产假和陪产读计数每10000也绘制个人复制和单核苷酸多态性(底部)。的总数检测编码单核苷酸多态性及其对应的颜色与所示颜色尺度。gydF4y2BacgydF4y2Ba父亲读的比例是由不同深浅的灰色表示核糖体入住率(降低与橙色三角形边界)和RNA表达(用蓝色上三角形边界)。微分核糖体基因显示参与allele-specific的方式与RNA表达被分为四个集群。每个集群中典型的共享模式是显示在右边。gydF4y2Ba
我们接下来考虑是否有任何gene-specific异常观测到全球模式的等位基因的比例在核糖体RNA表达和入住率在小鼠早期胚胎。正如预期的那样,大多数的基因表现出类似的父亲比读取核糖体RNA表达和入住率(扩展数据图。gydF4y2Ba5 c, dgydF4y2Ba)。一个例子的基因,gydF4y2BaHsp90ab1gydF4y2Ba,有八个不同的编码单核苷酸多态性分化的两个等位基因在多个复制RNA-seq Ribo-ITP。父亲的等位基因的高相似性比例在核糖体RNA表达和入住率一直观察多个复制和由不同的单核苷酸多态性(无花果。gydF4y2Ba4 bgydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
我们还发现了24微分核糖体基因参与allele-specific的方式与RNA表达(两个示例测试比例平等的;方法)。这些24基因集群分成四组模式的基础上allele-specific表达式(无花果。gydF4y2Ba4摄氏度gydF4y2Ba)。虽然集群和集群II包括基因显示一致的allele-specific核糖体入住率偏见在早期发展(扩展数据图。gydF4y2Ba6 b, cgydF4y2Ba),基因在其他两个集群allele-specific核糖体入住率stage-dependent的方式显示。gydF4y2Ba
特别是,包括几个基因gydF4y2BaEif3dgydF4y2Ba显示延迟接触新转录的父亲与核糖体RNA。具体来说,父亲的等位基因是强劲表现在4个胚胎,然而核糖体协会的等位基因是推迟到八细胞阶段(无花果。gydF4y2Ba4 dgydF4y2Ba和扩展数据图。gydF4y2Ba6 dgydF4y2Ba(集群III))。这个观察表明,特定的记录可能有慢动力学的核出口或隐藏在平移不活跃的隔间,直到他们的后续与核糖体发生在发展到八细胞阶段。gydF4y2Ba
最后一组基因(包括集群IV)gydF4y2BaCdk1gydF4y2Ba、细胞周期调控的重要元素gydF4y2BaBaz1agydF4y2Ba染色质重塑因子(无花果。gydF4y2Ba4 egydF4y2Ba和扩展数据图。gydF4y2Ba6 e, fgydF4y2Ba)。在一起,我们的研究结果显示,对于大多数成绩单,核糖体订婚与合子的激活和父亲的RNA表达并发。然而,少量展览allele-specific核糖体订婚期间不同阶段。gydF4y2Ba
发现潜在的遗传机制allele-specific翻译效率,我们决定单核苷酸多态性预测改变rna结合蛋白(RBP)图案或其他潜在的翻译管理序列(扩展数据图。gydF4y2Ba7得了gydF4y2Ba和补充表gydF4y2Ba2gydF4y2Ba)。我们确定了27个snp(13 24基因在无花果。gydF4y2Ba4摄氏度gydF4y2Ba)改变RBP allele-specific地图案。其中包括绑定图案变化的几个平移监管者(DAZL, CPEB1和PUM1)以前涉及早期小鼠胚胎发育gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba。我们还确定了allele-specific图案SRSF1核糖体入住率较高有关gydF4y2BaTsen2gydF4y2Ba和gydF4y2BaEif3dgydF4y2Ba。核糖体RNA的表达和分析数据显示,SRSF1强劲表现在早期胚胎。考虑到建立SRSF1作为转化催化剂的作用在其它场合gydF4y2Ba27gydF4y2Ba翻译,我们的数据显示这个RBP作为一个潜在的监管机构在小鼠早期发育。此外,一个SNP (UTR) 5′端非翻译区gydF4y2BaTmppegydF4y2Ba将支持翻译的上游开放阅读框(uORF) C57BL等位基因(扩展数据图。gydF4y2Ba7 bgydF4y2Ba)。我们观察到核糖体的入住率低gydF4y2BaTmppegydF4y2Ba从C57BL等位基因与已知的uORFs抑制作用一致gydF4y2Ba28gydF4y2Ba。在一起,这些结果表明,大量的机制可能构成微分allele-specific核糖体接触,包括改变RBP绑定。gydF4y2Ba
在开发过程中微分翻译效率gydF4y2Ba
我们接下来transcript-specific变化特征在翻译研究发展阶段。记录最高的可变性的核糖体入住率透露两大转变:一个胚胞阶段和MII-stage卵母细胞之间,另一个two-cell-stage和four-cell-stage胚胎(图之间的关系。gydF4y2Ba5gydF4y2Ba)。然后我们专注于识别的转录差异转化水平,也就是说,与微分翻译效率,所定义的重大变化在核糖体占用控制RNA丰富(方法)。gydF4y2Ba
一个gydF4y2Ba最高的,五十个基因变异在核糖体入住率在发展阶段绘制(方法)。颜色对应的均值集中日志核糖体占用的比例。gydF4y2BabgydF4y2Ba火山的情节描述统计学意义(gydF4y2BaygydF4y2Ba轴)和日志gydF4y2Ba2gydF4y2Ba褶皱变化(gydF4y2BaxgydF4y2Ba轴)之间的翻译效率两个发展阶段(方法)。颜色的点显示出成绩单和显著差异(错误发现率小于0.01)。gydF4y2BacgydF4y2Ba,集中log-ratio规范化阅读数量从Ribo-ITP RNA-seq实验绘制突出显示的基因。所有复制测量从给定的发展阶段。gydF4y2BadgydF4y2Ba、浓缩和损耗的RBP图案是由石棉水泥板gydF4y2Ba55gydF4y2Ba(Benjamini-HochberggydF4y2BaPgydF4y2Ba< 0.0001;补充表gydF4y2Ba5克ydF4y2Ba)和注释的点缀gydF4y2Ba56gydF4y2BaRBPs。RBPs,共享相同的图案是用逗号分隔的共识,和RBPs没有检测到表达都标有星号。TE,翻译效率。gydF4y2BaegydF4y2Ba成绩单,按他们的意思是保利(A)分组尾巴长度在受精卵六个大小相等的垃圾箱。相应的翻译效率的分布(方法)是可视化使用箱线图。水平线对应于中值,代表四分位范围和胡须的盒子四分位范围扩大到1.5倍。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba桑基图描述蛋白质丰度之间的关系,核糖体RNA表达和入住率。链接的颜色和厚度连接节点是修正后的斯皮尔曼等级相关的强度成正比(方法)。gydF4y2Ba
我们发现了大量的基因表现出翻译效率变化MII期卵母细胞成熟从胚泡,以及受精(图。gydF4y2Ba5 bgydF4y2Ba,扩展数据图。gydF4y2Ba7gydF4y2Ba和补充表gydF4y2Ba3gydF4y2Ba)。之间的129个基因转化调节在受精,126没有显著改变RNA表达(错误发现率小于0.01;一个细胞的胚胎和MII-stage卵母细胞;无花果。gydF4y2Ba5 b, cgydF4y2Ba)。这些基因大大丰富了细胞骨架组织(确切概率法的优势比4.67;gydF4y2BaPgydF4y2Ba= 8.5×10gydF4y2Ba−9gydF4y2Ba;补充表gydF4y2Ba4gydF4y2Ba),包括gydF4y2BaApcgydF4y2Ba连同其他几个基因中心体组织(例如,gydF4y2BaCenpegydF4y2Ba,gydF4y2BaCep120gydF4y2Ba,gydF4y2BaCamsap1gydF4y2Ba和gydF4y2BaNuma1gydF4y2Ba)。第一次有丝分裂在哺乳动物中既长又比体细胞有丝分裂事件更容易出错gydF4y2Ba29日gydF4y2Ba。此外,受精的划定的开始从多极acentrosomal部门转变为典型的双极纺锤波由中心体gydF4y2Ba30.gydF4y2Ba。关键的是,gydF4y2BaApcgydF4y2Ba需要激活这个重组和激活的动态构成小鼠胚胎的延长第一次有丝分裂gydF4y2Ba31日gydF4y2Ba。我们的研究结果揭示了微分翻译效率的一个关键调节机制这类记录没有任何转录。gydF4y2Ba
接下来,我们考虑翻译调控之间的关系和RNA稳定发展过渡。鉴于没有新的转录发生,任何减少RNA表达具体可以归因于退化。我们发现一个重要的重叠rna表达和rna中显著降低转化表达下调的受精卵(确切概率法的优势比5.87;gydF4y2BaPgydF4y2Ba= 2.24×10gydF4y2Ba−9gydF4y2Ba;扩展的数据图。gydF4y2Ba8gydF4y2Ba),这表明这两个基因表达模式可能函数表现为协同作用。gydF4y2Ba
当我们两个胚胎合子相比,我们发现了一个重要的浓缩RBPs基因增加了转化效率(确切概率法的优势比2.93;gydF4y2BaPgydF4y2Ba= 3.1×10gydF4y2Ba−10gydF4y2Ba;补充表gydF4y2Ba3gydF4y2Ba)。这包括三个基因功能的“读者”gydF4y2BaNgydF4y2Ba6gydF4y2Ba-methyladenosine RNA修改(gydF4y2BaHnrnpa2b1gydF4y2Ba,gydF4y2BaYthdf2gydF4y2Ba和gydF4y2BaYthdc1gydF4y2Ba;无花果。gydF4y2Ba5 b, cgydF4y2Ba)。最近的研究揭示了所有这三个基因被成功的早期胚胎发育所必需的gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba。孕产妇损耗的gydF4y2BaYthdf2gydF4y2Ba在老鼠身上引起胞质分裂缺陷和逮捕两个阶段gydF4y2Ba33gydF4y2Ba。同样,减少gydF4y2BaHnrnpa2b1gydF4y2Ba表达后胚胎发育延迟4个阶段gydF4y2Ba32gydF4y2Ba。最近的分析gydF4y2BaHnrnpa2b1gydF4y2Ba表达在胚胎植入前的开发过程中发现的差异可以忽略不计RNA表达受精卵和因子之间的小鼠胚胎,尽管两个显著增加其蛋白质丰富的胚胎gydF4y2Ba32gydF4y2Ba。我们的分析表明,增强翻译gydF4y2BaHnrnpa2b1gydF4y2Ba对这种现象可能是负责任的。虽然gydF4y2BaNgydF4y2Ba6gydF4y2Ba-methyladenosine“读者”显示在两个胚胎,提高翻译效率的关键demethylase删除gydF4y2BaNgydF4y2Ba6gydF4y2Ba-methyladenosine,gydF4y2BaAlkbh5gydF4y2Ba(ref。gydF4y2Ba36gydF4y2Ba),是一个最重要的表达下调基因的翻译效率(图。gydF4y2Ba5度gydF4y2Ba;调整gydF4y2BaPgydF4y2Ba= 8.4×10gydF4y2Ba−8gydF4y2Ba)。在一起,我们的研究结果揭示转化调控co-regulation共享模式的基因参与gydF4y2BaNgydF4y2Ba6gydF4y2Ba-methyladenosine rna的修改。gydF4y2Ba
探索与微分翻译效率相关的潜在机制,我们进行了客观的分析七聚物图案浓缩或损耗的差异基因(方法;补充表gydF4y2Ba5克ydF4y2Ba)。几个七聚物匹配RBP共识主题并显示一致的浓缩或消耗在微分基因阶段,建议参与塑造表达在早期发展(无花果。gydF4y2Ba5 dgydF4y2Ba,扩展数据图。gydF4y2Ba7 fgydF4y2Ba和补充表gydF4y2Ba5克ydF4y2Ba)。特别是,我们发现成绩单DAZL-binding网站在其3′utr被转化表达下调的过渡从受精卵到两个阶段(图。gydF4y2Ba5 dgydF4y2Ba)。DAZL曾被视作转化催化剂在配子形成gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba37gydF4y2Ba。两个胚胎过渡的划定的一个细胞显著减少DAZL丰富与基因与DAZL-binding差别转化对这些网站的3′utrgydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba。这些发现表明,DAZL可能也有一个重要的监管作用的背景下,胚胎植入前的发展在配子形成过程中除了已知的角色。gydF4y2Ba
保利(A)尾长度变化是一个重要的调节机制控制翻译效率在小鼠卵母细胞减数分裂成熟gydF4y2Ba38gydF4y2Ba和早期的发展gydF4y2Ba非洲爪蟾蜍gydF4y2Ba和斑马鱼gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba。我们使用TAIL-seq测量从一个细胞和小鼠胚胎两个阶段gydF4y2Ba41gydF4y2Ba,发现聚(A)尾长度是受精卵的翻译效率显著相关(无花果。gydF4y2Ba5 egydF4y2Ba;斯皮尔曼等级相关的0.32;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba)。然而,保利(A)尾长度和翻译之间的耦合效率是完全失去了由两个阶段与合子基因组激活(扩展数据图。gydF4y2Ba8 bgydF4y2Ba;斯皮尔曼等级相关的0.001;gydF4y2BaPgydF4y2Ba= 0.9;扩展的数据图。gydF4y2Ba10gydF4y2Ba)。以前的工作gydF4y2Ba40gydF4y2Ba假定保利(一)尾长度会调节转录翻译系统中是压抑和胞质聚腺苷酸化是活跃的。我们的分析验证这种预测在哺乳动物的生物,与在斑马鱼和青蛙胚胎的发现一致gydF4y2Ba40gydF4y2Ba。gydF4y2Ba
探索为什么保利(A)尾长度之间的强耦合和翻译效率分解在后期的开发中,我们分析了PABPC1表达式,调和了保利(A)尾长度对翻译的影响gydF4y2Ba42gydF4y2Ba。我们发现PABPC1本身就是监管转化,其意思是保利(A)尾巴明显延长two-cell-stage胚胎而受精卵(扩展数据图。gydF4y2Ba8 cgydF4y2Ba)。这些发现表明极限存在PABPC1受精卵作为一个潜在的解释之间的耦合保利(a)尾长度和翻译效率,与结果一致gydF4y2Ba非洲爪蟾蜍gydF4y2Ba卵母细胞gydF4y2Ba43gydF4y2Ba。总的来说,我们的研究结果表明保利(a)尾长度守恒的角色在决定翻译老鼠胚胎发生的早期阶段的效率。gydF4y2Ba
翻译效率贡献蛋白质丰度gydF4y2Ba
受精卵的蛋白质组是由母亲般地把这些新合成蛋白质和受精后gydF4y2Ba1gydF4y2Ba。我们评估翻译的贡献在确定蛋白质丰度使用质谱测量从大约8000个胚胎小鼠胚胎植入前的发展的每个阶段gydF4y2Ba6gydF4y2Ba。从超过5000个基因中发现我们的单个胚胎核糖体分析和RNA-seq实验中,3287个基因被量化在蛋白质水平gydF4y2Ba6gydF4y2Ba。gydF4y2Ba
我们发现受精卵的蛋白质组只是适度与RNA表达的受精卵(斯皮尔曼等级相关的0.34;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba与以前的工作报告),在协议弱RNA和蛋白质表达丰度之间的相关性gydF4y2Ba6gydF4y2Ba,gydF4y2Ba44gydF4y2Ba。相比之下,受精卵的蛋白质丰度明显与合子的核糖体入住率和翻译效率比RNA表达(0.45和0.41和0.34的斯皮尔曼等级相关;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba;无花果。gydF4y2Ba5 fgydF4y2Ba和扩展数据图。gydF4y2Ba9 d-fgydF4y2Ba)。gydF4y2Ba
至关重要的是,我们发现翻译的效率胚胞阶段卵母细胞与受精卵的蛋白质丰度有最强的关系(图gydF4y2Ba5 fgydF4y2Ba和扩展数据图。gydF4y2Ba9 dgydF4y2Ba;斯皮尔曼等级相关的0.53,gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba)。这个关键的贡献是无法觉察的RNA的RNA表达丰度水平胚胞阶段卵母细胞更弱与合子的蛋白质丰度(0.31的斯皮尔曼等级相关;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba)。我们的研究结果显示,产妇翻译合子的蛋白质组是主要的因素。gydF4y2Ba
快速降解的耦合的母亲般地爆发沉积RNA和受精卵的转录从根本上重塑发展中胚胎的RNA含量。因此,four-cell-stage胚胎有非常不同的RNA成分与one-cell-stage two-cell-stage胚胎。核糖体入住率和RNA表达与蛋白质丰度呈正相关(图4个或八细胞阶段。gydF4y2Ba5克gydF4y2Ba和扩展数据图。gydF4y2Ba8 hgydF4y2Ba)。相反,我们发现,核糖体入住率和RNA表达在four-cell-stage eight-cell-stage胚胎更密切相关的蛋白质丰度在桑椹胚阶段(无花果。gydF4y2Ba5克gydF4y2Ba;斯皮尔曼等级相关的0.66和0.50在4个阶段和0.69和0.53在八细胞阶段;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba)。这些结果表明,蛋白质之间的相互作用的稳定性和生产造成的动态蛋白质丰度在老鼠胚胎植入前的胚胎发育。gydF4y2Ba
成绩单的翻译效率与等位基因偏见gydF4y2Ba
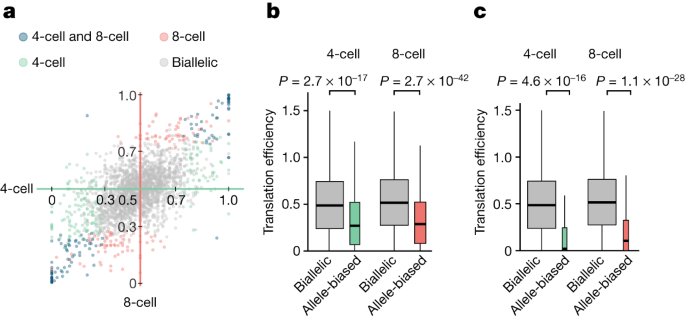
parent-of-origin-specific表达哺乳动物早期胚胎发育是至关重要的gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba。然而,人们很少知道平移控制的基因显示allele-biased表达式。由4个阶段,大多数基因都有两个等位基因的转录比例几乎相等(biallelic表达式;无花果。gydF4y2Ba4gydF4y2Ba)。我们首次发现的基因集偏离这种模式,这样的一个等位基因占总数的70%以上成绩单(allele-biased;无花果。gydF4y2Ba6gydF4y2Ba)。我们发现基因显示allele-biased表达显著减少有效翻译four-cell-stage和eight-cell-stage胚胎(无花果。gydF4y2Ba6 bgydF4y2Ba;Wilcoxon秩和检验gydF4y2BaPgydF4y2Ba≤2.7×10gydF4y2Ba−17gydF4y2Ba;中隆改变= 0.55)。最极端的形式的等位基因偏见是monoallelic表达式。这种monoallelically表达基因的翻译效率降低甚至比biallelic基因(gydF4y2BaPgydF4y2Ba≤4.6×10gydF4y2Ba−16gydF4y2Ba;中隆改变≤0.2,分别)。此外,观察到的差异的翻译效率是一致的不管基因表达在父或母亲般地偏见的方式(扩展数据图。gydF4y2Ba9 a、bgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba,对于每一个记录,我们在复制RNA聚合表达式和阶段性snp的比例来确定读取总支持父亲的等位基因。由等位基因的RNA表达的偏见在four-cell-stage (gydF4y2BaxgydF4y2Ba轴)和eight-cell-stage (gydF4y2BaygydF4y2Ba轴)的胚胎。gydF4y2BabgydF4y2Bafour-cell-stage和eight-cell-stage胚胎,翻译效率(也就是说,核糖体入住率除以RNA表达)allele-biased和biallelic基因比较使用双面Wilcoxon等级和测试。gydF4y2BacgydF4y2Ba,翻译效率biallelic基因与那些monoallelically表示(0或1)的比率。箱线图,水平线对应于中值,代表四分位范围和胡须的盒子四分位范围扩大到1.5倍。gydF4y2Ba
识别allele-biased表达式从RNA-seq数据可能会遭遇技术偏差gydF4y2Ba50gydF4y2Ba。解决潜在的文物,我们做了几个额外的控制。首先,我们定义了一个更高的信心的一组基因的allele-biased表达式是由多个snp。这组同样低转换效率(扩展数据图。gydF4y2Ba9 cgydF4y2Ba;gydF4y2BaPgydF4y2Ba≤1.4×10gydF4y2Ba−14gydF4y2Ba;中隆改变= 0.57)。接下来,排除潜在的干扰RNA表达的差异或编码序列的长度,我们选择的子集biallelic表达基因,这样他们的RNA allele-biased基因的丰度和cd长度分布匹配那些在各自胚胎阶段。观察到的不同的翻译效率仍然显著,当匹配集比较(扩展数据图。gydF4y2Ba9 dgydF4y2Ba;gydF4y2BaPgydF4y2Ba≤6.3×10gydF4y2Ba−5gydF4y2Ba;中隆改变≤0.68)。gydF4y2Ba
最后,我们测试了观察到的差异的翻译效率是否局限于基因的发展阶段allele-biased表达式,或由于内在特性导致糟糕的翻译。当比较基因表达与allele-biased那些biallelically表达four-cell-stage和eight-cell-stage胚胎,我们发现他们的翻译效率MII-stage卵子和受精卵(扩展数据图是没有区别的。gydF4y2Ba9情况gydF4y2Ba;gydF4y2BaPgydF4y2Ba值为0.41和0.33)。这些发现表明,成绩单翻译很差特别是在发展阶段的RNA表达allele-biased。在一起,我们的分析识别allele-biased转录和翻译之间的关系。gydF4y2Ba
讨论gydF4y2Ba
平移控制基因表达的一个必要的角色在小鼠胚胎发育的早期阶段。然而,技术的局限性杜绝分析allele-specific翻译由于缺乏监管单细胞和单个胚胎决议。我们克服了这个关键限制通过开发一个名为Ribo-ITP的微流体ITP技术。Ribo-ITP隔离rpf从单个细胞通过新技术相比,最近的一项研究,应用单细胞RNA-seq方法结合一个核糖核酸酶消化的步骤gydF4y2Ba51gydF4y2Ba。gydF4y2Ba
高覆盖率数据描述了微分翻译效率和第一个分析allele-specific核糖体入住率在小鼠胚胎植入前的发展。特别是,我们发现APC / C和中心体的几个组件转化调节受精。受精卵依赖于母亲般地沉积mrna启动改造细胞的有丝分裂项目环境,转变远离减数分裂分裂,中心体。因此,最初的胚胎植入前的有丝分裂发生在完全不同的细胞的条件下与体细胞分裂gydF4y2Ba30.gydF4y2Ba。我们的结果显示平移upregulation参与这种转变的关键部件gydF4y2Ba31日gydF4y2Ba。gydF4y2Ba
单细胞和单个胚胎定量的核糖体入住率避免了胚胎的异质性造成的批量分析。这项决议正是允许我们探测展览allele-specific核糖体基因参与。我们的分析表明微分allele-specific核糖体入住率RBP网站作为一个可能的因素的差异。我们推测,优先使用的孕产妇核糖体可能导致观察到的差异的翻译从母体和父亲一般地派生的rnagydF4y2Ba52gydF4y2Ba。未来的工作将区分潜在的父sequence-specific差异的起源。gydF4y2Ba
最后,我们评估翻译的贡献决定的蛋白质组小鼠胚胎植入前的胚胎。我们发现时间未能以前RNA的动力学表达式的分析。的例子类似颞脱节RNA和蛋白质丰富曾被观察到gydF4y2Ba果蝇gydF4y2Ba和gydF4y2Ba非洲爪蟾蜍gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba。我们的工作扩展了这些研究通过实验确定翻译的贡献在哺乳动物系统中。具体来说,我们发现胚胞阶段卵母细胞的核糖体占用,而不是受精卵,受精卵的蛋白质丰富的重要预测指标。未来努力把蛋白质和RNA稳定测量需要解决剩下的原因不明的蛋白质丰度的变化。这研究表明一种新生物的见解,我们可以期待Ribo-ITP从应用程序,这将有助于回答基本问题在平移控制相关样本有限的输入量,包括胚胎组织,癌症干细胞和瞬态人口。gydF4y2Ba
方法gydF4y2Ba
PDMS芯片制造gydF4y2Ba
模具被原型实验室分水岭XC 11122 3 d打印高分辨率(补充图。gydF4y2Ba1gydF4y2Ba)。可复用模具被录制3 d打印模具组装玻璃幻灯片(5“×4”;泰德斗篷)。Sylgard 184 PDMS单体和固化剂(4019862,埃尔斯沃思粘合剂)混合比例10:1 (w / w)。混合物是使用干燥器连接到真空泵脱气,倒在模具和脱气,直到没有气泡。模具是孵化至少16 h 50°C。个人PDMS芯片被削减的形成外矩形扩展数据图的设计。gydF4y2Ba1gydF4y2Ba。5毫米直径洗脱,落后于电解质,电解质水库是用活检打孔(扩展数据图。gydF4y2Ba1 bgydF4y2Ba)。在等离子体处理之前,玻片(4“×3”;泰德斗篷)和功能的PDMS石板被彻底清洗用胶带除去灰尘颗粒。PDMS芯片和玻片与115 V扩大等离子体等离子体清洗干净(Harrick等离子体)连接到一个干滚动泵(安捷伦)在无线电频率高级别2分钟。plasma-treated表面的玻璃和PDMS石板就聚集在一起形成一个共价键。保税芯片在80°C加热热块至少2 h提高粘结。gydF4y2Ba
PDMS芯片Ribo-ITP实验做准备gydF4y2Ba
RNAse-free芯片,确保清洁,我们预处理的渠道、水库Ribo-ITP芯片通过序贯治疗以下解决方案:RNaseZap集中(100%),nuclease-free水,1 M氢氧化钠,nuclease-free水,1 M盐酸,nuclease-free水、10% (w / v)苯甲酮丙酮(10分钟,补充渠道需要避免泡沫积累),甲醇和0.1% Triton x - 100。通道被完全吸尘完全干最后一次治疗后剩余的液体的通道。在保护芯片ProteinSimple 302/365nm紫外线透照器与胶带,我们增加了10%的聚丙烯酰胺预聚物混合(补充表gydF4y2Ba6gydF4y2Ba)通过洗脱尺寸选择通道。同样,5%聚丙烯酰胺预聚物混合加载到提取通道通过分支通道2。催化聚合的聚丙烯酰胺在芯片,我们使用photoactivatable azo-initiator, 2, 2′-azobis[2 -甲基-gydF4y2BaNgydF4y2Ba——(2-hydroxyethyl)丙酰胺)和光化学物质(va - 086, kouichi),最终在预聚物混合浓度0.5%。UV-driven聚合(波长为365 nm)进行1分钟休息30年代紧随其后。这个开关紫外线循环重复了两次紫外线照射时间3分钟。紫外线强度测量约8.9 mW厘米gydF4y2Ba−gydF4y2Ba2gydF4y2Ba使用g r实验室模型200与365 nm紫外线计调查。为了避免脱水后的聚丙烯酰胺凝胶聚合,我们任何打开的通道和水库装满了存储缓冲区(补充表gydF4y2Ba6gydF4y2Ba),直到使用。中使用的芯片是受光照和6小时的准备。gydF4y2Ba
国际旅游业伙伴关系的设置gydF4y2Ba
准备ITP芯片是放置在一个黑暗的读者蓝光透照器(克莱尔化学)和保护胶带。存储缓冲区被撤使用真空通道和水库。主要的电解质普朗尼克的解决方案(地蜡)和拖把拖电解质普朗尼克的解决方案(TEp)(补充表gydF4y2Ba6gydF4y2Ba在整个加载过程)被保存在冰。吸管技巧(200µl)保持在−20°C到实验的时间方便操纵pluronic-containing地蜡和TEp中的解决方案,巩固在一分钟4°C以上。地蜡,80µl加载在领先的电解质水库3中,充填储层顶部的小段洗脱之间的通道,导致电解液水库3(扩展数据图。gydF4y2Ba1 bgydF4y2Ba)。领先的电解质水库2充满了30µl地蜡,确保与聚丙烯酰胺凝胶出现在分支通道2。洗脱也充满了20µl运行缓冲(RB)。荧光标记寡核苷酸包含5′阿荧光团和3′,ddC阻塞修改(补充表gydF4y2Ba7gydF4y2Ba)被添加到样本与样本稀释缓冲稀释紧随其后。混合物被加载到溶解产物渠道主要电解质水库1。最后,导致电解液水库1充满了30µl地蜡和70年µl TEp加入电解质水库。负电极放置在拖尾电解质水库和正极电解液水库。正负电极放置在领先的电解液储层3和落后于电解液水库,分别。300毫安的恒流的最大电压1.1 kV(吉时利2410数字源表)是应用于通道。一旦结束后荧光标记进入5%聚丙烯酰胺凝胶,分支通道电极与较低的电流输出由于510 kΩ(Xikon)电阻器手工定制电路董事会主要应用于电解液水库1大约10 s。当短的荧光标记的前缘到达的最后尺寸选择频道,当前被停职。洗脱水库被彻底清洗两次30µl nuclease-free水和加10µl脱磷酸缓冲(补充表gydF4y2Ba6gydF4y2Ba)。当前应用直到荧光标记开始进入洗脱时间越长。最后,纯化样品的10-µl卷收集洗脱到low-bind PCR管并立即存放在−80°C。gydF4y2Ba
页面和传统提取的RNAgydF4y2Ba
控制输入作为主人准备混合然后整除。凝胶萃取样品,输入RNA首次加工使用试剂盒miRNeasy微Kit /制造商的指示。rna被使用TBE-urea 15%聚丙烯酰胺凝胶电泳分离(EC6885BOX,英杰公司)。凝胶片切除和使用无菌的杵碎,紧随其后的是浸泡在凝胶萃取缓冲区gydF4y2Ba57gydF4y2Ba(补充表gydF4y2Ba6gydF4y2Ba在干冰)30分钟。样品在室温下培养过夜,轻轻桌面瓶,免受光传输。残留的胶件在21130年被离心1分钟gydF4y2BaggydF4y2Ba0.22通过康宁-μm无菌过滤管。恢复洗出液沉淀一夜之间在−20°C(300毫米醋酸钠(pH值5.2),5毫米MgClgydF4y2Ba2gydF4y2Ba1.5µl Glycoblue和75%乙醇)。样品在4°C颗粒状的离心1 h,享年21130岁gydF4y2BaggydF4y2Ba。gydF4y2Ba
凝胶成像和量化gydF4y2Ba
量化产量、样本运行TBE-urea 15%聚丙烯酰胺凝胶和可视化使用由SYBR荧光标记寡核苷酸或黄金染色。具体来说,凝胶成像使用台风佛罗里达州9500(通用电气医疗集团)473 nm激发波长和低通带滤波器兼容阿488荧光团和SYBR黄金污渍。对高分辨率成像,像素大小是最小化(十到二十五µm)和光电倍增管(PMT)设置优化利用台风的扫描特性,以避免图像过饱和现象,通常导致250至500 V的值。图像进行分析使用ImageJ软件v.1.52 (NIH)。原始的集成密度背景信号(去掉(去掉)gydF4y2Ba背景gydF4y2Ba)是由量化测量平均rid代表空白区域。掉gydF4y2Ba背景gydF4y2Ba是归一化占的比例目标(gydF4y2Ba一个gydF4y2Ba样本gydF4y2Ba)的背景区域(gydF4y2Ba一个gydF4y2Ba背景gydF4y2Ba),这样gydF4y2Ba
规范化的背景值减去从所有样本量化标准化样本值。百分比收益率被定义为归一化掉的比例值的均值background-normalized输入样本。仅用于显示目的,一些图像的对比度和亮度调整ImageJ和数据导出为tiff文件。完整的扫描显示在补充图。gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
产量比较片上和传统的RNA提取方法gydF4y2Ba
输入控件和实验样本准备最后的总额40 ng 20 ng, 2 ng, 400 pg或40 pg ZR型小RNA梯(R1090 Zymo研究)包括17、21、25和29-nt RNA寡核苷酸。Ribo-ITP进行描述,最后在12µl RB洗脱。凝胶萃取样品前处理miRNeasy微工具包(试剂盒),其次是提取使用crush-and-soak方法gydF4y2Ba57gydF4y2Ba。只有25-nt和29-nt乐队提取。40 ng和20 ng样本,荧光标记寡核苷酸TBE-urea飙升到每个样本,最后15%聚丙烯酰胺凝胶是如上所述。只有25-nt和29-nt乐队量化来确定最终的产量。gydF4y2Ba
量化产生的超低输入样本(2 ng, 400 pg和40 pg输入),所有实验和输入控制样品被带到16µl nuclease-free水。随后,2µl T4多核苷酸激酶(PNK)缓冲区,1µl T4 PNK(内)和1µl ATP(γ-32P) -3000 Ci更易gydF4y2Ba−gydF4y2Ba1gydF4y2Ba(mCi 10毫升gydF4y2Ba−gydF4y2Ba1gydF4y2Ba)(NEG002A500UC,珀金埃尔默)添加和孵化为30分钟37°C。孵化后,非公司核苷酸与RNA被移除干净,Concentrator-5工具包(R1013 Zymo研究)根据制造商的指示。RNA被筛选了14µl nuclease-free水,混合着2×变性凝胶加载染料(补充表gydF4y2Ba6gydF4y2Ba)和变性为90年代在80°C。样本电泳,凝胶在nuclease-free孵化用水5分钟之后30分钟30%甲醇和5%甘油溶液中孵化。孵化项目都是在室温下摇摆平台上完成的。孵化项目后,凝胶之间放置pre-wetted玻璃纸表(1651779,Bio-Rad)和干2 h GelAir干燥系统(Bio-Rad)。干凝胶玻璃纸暴露了至少12 h BAS-IP荧光屏女士(28956475,通用电气医疗集团)。荧光屏成像是台风佛罗里达州9500(通用电气医疗集团)使用500 V PMT 50-µm决议。图像可视化和量化使用ImageJ软件;只有25-nt乐队量化如上所述。所有样品都是加工一式四份,除了Ribo-ITP样本的RNA梯输入20 ng (gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba
细胞培养gydF4y2Ba
人类K562细胞生长在RPMI 1640介质(Gibco)补充10%胎牛血清(penicillin-streptomycin Gibco)和1% (Gibco)和孵化37°C公司为5%gydF4y2Ba2gydF4y2Ba密度约为2.5×10gydF4y2Ba5克ydF4y2Ba细胞每毫升。定期检测支原体污染细胞。K562细胞株的身份验证是使用短串联重复序列分析从美国文化集合类型。gydF4y2Ba
大小选择净化RNAgydF4y2Ba
展示我们芯片上的尺寸选择能力的方法,我们准备一个MNase-digested RNA样本K562细胞。总之,3µl MNase(位于内布拉斯加州M0247S)添加到澄清K562从大约500万个细胞溶解产物和消化为30分钟37°C,其次是与miRNeasy微RNA提取工具包(试剂盒)制造商的指示。Ribo-ITP输入包含100 ng的消化,纯化RNA。Ribo-ITP进行描述,修改集合的方法。一旦荧光标记乐队达到5%和10%聚丙烯酰胺凝胶的接口,目前暂停,RB 12µl新鲜RB所取代。Ribo-ITP一直持续到第一个荧光标记达到洗脱的边缘。12个µl RB的洗脱好收集,分数1所示。然后被洗两次,RB加12µl RB。当前的前沿应用直到拖曳荧光标记开始进入洗脱,和12µl RB收集洗脱部分2。洗脱好加12µl RB, Ribo-ITP持续了2分钟。 The final 12 µl elution was collected as fraction 3. Control inputs were prepared with the same amounts of bulk RNA and fluorescent markers, then brought to 12 µl with RB. Gel electrophoresis, imaging and quantification were performed as described.
核糖体分析样品制备和单体隔离gydF4y2Ba
大约1000万K562细胞颗粒状,洗两次与PBS和立即在液态氮被迅速冻结。细胞细胞溶解在400年µl冷裂解缓冲(补充表gydF4y2Ba6gydF4y2Ba在冰上)10分钟,用移液器吸取同质化。在1300年明确溶菌产物离心gydF4y2BaggydF4y2Ba10分钟在4°C。澄清上层清液消化了5µl MNase(位于内布拉斯加州M0247S)和孵化为30分钟37°C。消解时停止了20毫米核糖核苷vanadyl复杂(位于内布拉斯加州S1402S)。样本然后装上20 - 50%蔗糖梯度离心器在SW41 Ti swinging-bucket转子(贝克曼331362年)38000 rpm为2.5 h在4°C。样本使用Biocomp梯度分馏塔分馏。RNA提取的单体与miRNeasy分数微工具包(试剂盒)。三分之一的洗出液是通过TBE-urea 15%聚丙烯酰胺凝胶电泳。大约17-35 nt的核糖体足迹凝胶使用crush-and-soak方法提取所述。最终样品乙醇沉淀后再悬浮在18µl nuclease-free水。纯化RNA与1µl T4脱去磷酸多核苷酸激酶(内)1×T4 PNK缓冲区1 h在37°C。 Dephosphorylated ribosome footprints were then ethanol precipitated (300 mM sodium acetate, 2.5 volumes of ethanol and 1.5 µl of GlycoBlue) overnight at −20 °C. Precipitated RNA was eluted in 10 µl nuclease-free water. The RNA was normalized to 350 ng in 6 µl of nuclease-free water before library preparation.
100 -细胞核糖体分析实验,K562细胞颗粒状,洗两次与PBS稀释至100细胞5µl冷裂解缓冲含有环己酰亚胺。MNase股票(每微升2000凝胶单位;内)稀释1:50和1µl稀释的添加到样本。消化了30分钟37°C的热循环与加热盖。EGTA(1µl)添加到最后10毫米的浓度抑制进一步消化。通过Ribo-ITP样本放在冰直到处理。三个复制传统核糖体剖析和Ribo-ITP准备。gydF4y2Ba
为单细胞Ribo-ITP实验,细胞颗粒状,享年300岁gydF4y2BaggydF4y2Ba为5分钟。这些细胞被洗1×PBS和resuspended达到约1×10gydF4y2Ba6gydF4y2Ba细胞1毫升的PBS含有0.1% BSA(σ)与1µg毫升gydF4y2Ba−1gydF4y2BaDAPI。细胞经过紧张上限获得单细胞悬液和排序索尼MA9000细胞分选仪或BD FACSAria融合流式细胞分析仪埃普多夫LoBind 96 -孔板包含5µl冷裂解缓冲环己酰亚胺。单线态细胞被定义为浇注在FSC-A / SSC-A SSA-H / SSC-W FSC-A / FSC-H和FSC-A /直方图。活细胞选择使用DAPI-negative浇注。盘子是密封和flash在液态氮冷冻后立即完成。溶菌产物孵化在37°C和1µl MNase 1:15 0稀释的股票(每微升2000凝胶单位;内)30分钟或1µl施用稀释的核糖核酸酶(100 UµlgydF4y2Ba−1gydF4y2Ba;Ambion) 15分钟。MNase消化了通过添加EGTA 10毫米的最终浓度。十二烷基硫酸钠添加到最终的浓度0.1%,样品与核糖核酸酶消化即溶菌产物举行在冰上,直到通过Ribo-ITP处理。gydF4y2Ba
小鼠卵母细胞隔离gydF4y2Ba
所有实验用老鼠老鼠基因工程设施机构批准的动物保健和使用委员会在德克萨斯大学奥斯汀分校(协议ID: aup - 2022 - 00114)。老鼠被安置在22°C(范围20 - 24°C)在12 h的光暗周期。没有控制湿度。卵母细胞是来自超数排卵女性C57BL / 6 j小鼠(大约8周大)如前所述gydF4y2Ba18gydF4y2Ba。一小时后人体绒毛膜促性腺激素(hCG)注入,卵巢被放置在一个3厘米菜包含《男人帮》中(F1114 Cytospring)和胚胞阶段卵母细胞被刮卵巢的表面释放与# 5。杜蒙钳(Roboz)。MII-stage卵母细胞被孤立于输卵管hCG注射后大约14 h。积云细胞被删除从卵母细胞治疗1毫克毫升gydF4y2Ba−1gydF4y2Ba透明质酸酶(H3884σ)在《男人帮》中。胚胞阶段和MII-stage卵母细胞被冲洗到三滴《男人帮》中,然后通过三个滴20毫克毫升gydF4y2Ba−1gydF4y2BaBSA (A3311σ)PBS (SH30028.02 Hyclone)。卵母细胞被单独放置在0.2毫升PCR管使用立体显微镜下细拉玻璃吸管和flash在液态氮冷冻。卵母细胞的液体体积转移µl小于0.5。没有统计分析用于确定样本容量。给定的观测特性研究中,没有使用随机化或致盲。gydF4y2Ba
使用铸/ EiJ精子体外受精gydF4y2Ba
从精子冷冻铸造/ EiJ雄鼠如前所述gydF4y2Ba58gydF4y2Ba并存储在液态氮。体外受精,卵母细胞与C57BL / 6 j雌性老鼠大约15 h hCG注射后,执行和体外受精使用解冻投/ EiJ精子gydF4y2Ba59gydF4y2Ba。一个细胞因子,4个和八细胞胚胎收集21.5,39岁,分别为62人和69 h hCG注射后,。一夜之间,受精的卵母细胞被培养两个阶段在150年µl一滴信托基金中(mH0113 Cytospring)。发展4个和八细胞阶段,两个胚胎培养核自组织映射聚类介质中(K0114 Cytospring)。胚胎被单独放置到0.2毫升PCR管和flash在液态氮冷冻。所有样本处理Ribo-ITP 48小时内的集合。gydF4y2Ba
一个工作裂解缓冲溶液制备通过添加1µl MNase(内)(1:50稀释)5µl裂解缓冲。溶解鼠标样品6µl裂解缓冲工作是直接添加到冷冻cell-containing滴。消化立即进行30分钟37°C的热循环与加热盖。EGTA(1µl)添加到最后10毫米的浓度抑制进一步消化。通过Ribo-ITP样本放在冰直到处理。gydF4y2Ba
核糖体剖析图书馆准备和测序gydF4y2Ba
传统核糖体足迹库后单体隔离(即350 ng RNA样本6µl nuclease-free水)生成使用Clontech聪明smRNA-seq工具包使用八个PCR循环(豆类生物)。纯化PCR, 30µl AMPure XP珠子(A63880,贝克曼库尔特)根据制造商的指示和筛选了30µl nuclease-free水。最终的尺寸选择与BluePippin系统进行科学(Sage)使用3% dye-free琼脂糖磁带(BDQ3010,圣人科学)。gydF4y2Ba
Ribo-ITP实验与人类K562细胞和小鼠样本,D-Plex小RNA-seq工具包(C05030001 Diagenode)使用少量修改如下详细。去磷酸化反应是补充0.5µl T4 PNK(内)和反应是孵化了25分钟。反转录的模板切换低聚糖在nuclease-free水稀释1:2。所有人类100 -细胞样品和三个MII-stage卵母细胞处理使用单一索引模块;而其他鼠标样本使用独特的双索引模块处理。一半的互补DNA(互补)放大了17 PCR循环和1:4稀释的图书馆被安捷伦评估生物分析仪灵敏度高DNA工具包。目标的浓度峰值被用来池和样品大约克分子数相等的表示。AMPure XP珠清理执行(1.8×)其次是大小选择用3%琼脂糖,dye-free凝胶与内部标准磁带(BDQ3010,圣人科学)BluePippin平台。紧173 - 207 bp的参数设置范围是用于准备样品单指数模块。紧参数设置范围183 - 217 bp的用于样品准备了独特的双指数模块。 For the RNase I-digested single-cell libraries, final size selection was performed by PAGE purification of 200-bp products. Samples were sequenced on an Illumina NovaSeq 6000. For mouse samples, five, five, five, three, three and four biological replicates were used for germinal vesicle, MII, one-cell, two-cell, four-cell and eight-cell stages, respectively.
单细胞和单个胚胎RNA-seqgydF4y2Ba
总RNA-seq图书馆准备Smart-seq3 V.3 (ref。gydF4y2Ba60gydF4y2Ba),修改。未孕鼠样本(胚泡和信息产业部)和vitro-fertilized鼠标样品(一个细胞因子,4个和八细胞阶段)是细胞溶解和反向转录所描述。互补脱氧核糖核酸与13 pre-amplified PCR循环和珠纯化与AMPure XP(1.8×)最后洗脱5µl nuclease-free水。pre-amplified cDNA、1µl评估了生物分析仪灵敏度高DNA工具确认成功pre-amplification和适当的大小。另一1µl评估在量子位使用双链DNA高灵敏度(HS)测定pre-amplified cDNA量化。样本稀释nuclease-free水和规范化600 pg输入(100 pgµlgydF4y2Ba−1gydF4y2Ba)和受到tagmentation post-tagmentation PCR。tagmentation和随后的PCR扩大6×:准确地说,600 pg pre-amplified cDNA tagmented 6µl tagmentation混合,添加9µl Nextera指数的引物和18µl tagmentation PCR混合使用。十六个PCR循环进行随后equivolume样品池(12µl每个PCR产品)和AMPureXP净化1×比率。最后库大小分布和浓度与HS DNA生物分析仪进行评估。6000测序进行与Nova Seq paired-end读取(使用100周期包:60 + 40)。信息产业部,胚泡一个细胞、因子4个和八细胞阶段,4、4、4、4、分别两个和四个生物复制被测序。gydF4y2Ba
核糖体分析数据的计算处理gydF4y2Ba
使用RiboFlow核糖体分析数据处理gydF4y2Ba61年gydF4y2Ba。我们提取第一个12元的5′末端使用UMI-tools读取gydF4y2Ba62年gydF4y2Ba1.1.1版用以下参数:“umi_tools提取- P”^ (? P < umi_1 >。{12}) (? P < discard_1 >。{4}) + $“提取方法=正则表达式”。4元下游独特的分子指标(umi)逆转录过程中丢弃的书中步骤。不包括umi传统核糖体分析样本。gydF4y2Ba
接下来,我们剪3′适配器AAAAAAAAAACAAAAAAAAAA使用cutadapt Ribo-ITP数据gydF4y2Ba63年gydF4y2Ba1.18版本的参数”——AAAAAAAAAACAAAAAAAAAA-overlap = 4-trimmed-only”。对于传统的核糖体分析数据,我们删除了保利(A)反面和第一读取使用的3元“cutadapt - u 3——AAAAAAAAAA-overlap = 4-trimmed-only”。gydF4y2Ba
UMI提取和适配器削减之后,读取与核糖体和转移rna一致使用Bowtie2 (ref。gydF4y2Ba64年gydF4y2Ba2.3.4.3)版本。手动对齐读取被映射到一个策划转录组。我们保留比对映射质量大于2其次是重复数据删除使用UMI-tools时适用。重复数据删除的外部库没有umi,一组读相同的长度,被映射到一个相同的核苷酸位置倒塌成一个单一的阅读。作为最后一步,.ribo使用RiboPy创建的文件gydF4y2Ba61年gydF4y2Ba0.0.1版本。所有后续分析使用核糖体29-35 nt的足迹长度。gydF4y2Ba
对于涉及nucleotide-resolution数据的分析,我们确定了一个站点抵消每个核糖体足迹长度使用翻译停止网站metagene情节。具体来说,对于每个读取长度,我们确定了最高峰上游的翻译停止网站和使用注释停止网站之间的距离作为偏移量。gydF4y2Ba
分配编码核糖体脚印阅读框架(0,1,2),我们首先计算之间的距离5′末端的足迹和第一个核苷酸编码序列,把模3的距离。接下来,核糖体的足迹被他们的长度和分区2 nt上游和下游1元3′末端的足迹。对于每一组,我们决定读取的总数,分配给每一个阅读框,给我们三个数字(gydF4y2Ba年代gydF4y2Ba0gydF4y2Ba,gydF4y2Ba年代gydF4y2Ba1gydF4y2Ba和gydF4y2Ba年代gydF4y2Ba2gydF4y2Ba),gydF4y2Ba年代gydF4y2Ba我gydF4y2Ba框架里的脚印的总数吗gydF4y2Ba我gydF4y2Ba。我们周期性改变这些数字的最大数量是分配给第一个组件。循环变化之后,我们汇总所有三胞胎特定组件。产生的三联体(gydF4y2BaTgydF4y2Ba0gydF4y2Ba,gydF4y2BaTgydF4y2Ba1gydF4y2Ba和gydF4y2BaTgydF4y2Ba2gydF4y2Ba)提供了调整阅读框架gydF4y2BaTgydF4y2Ba我gydF4y2Ba修正后的数字足迹的框架gydF4y2Ba我gydF4y2Ba。我们比较产生的阅读框分布(gydF4y2BaTgydF4y2Ba0gydF4y2Ba,gydF4y2BaTgydF4y2Ba1gydF4y2Ba和gydF4y2BaTgydF4y2Ba2gydF4y2Ba)随机分布框架,预期值是(gydF4y2BaTgydF4y2Ba0gydF4y2Ba+gydF4y2BaTgydF4y2Ba1gydF4y2Ba+gydF4y2BaTgydF4y2Ba2gydF4y2Ba每一帧)/ 3(卡方统计,gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba对所有实验)。gydF4y2Ba
RNA-seq数据的计算处理gydF4y2Ba
5′适配器序列“ATTGCGCAATG”剪使用cutadapt从两人的第一次读gydF4y2Ba63年gydF4y2Ba1.18版。剪短于读取8元被使用:“cutadapt - j 4-trimmed-only 8 g - m ATTGCGCAATG”。然后提取下一个8元对应的umi首先读入两和附加他们的头(FASTQ文件)读取对使用UMI-tools用以下参数:“umi_tools extract-bc-pattern n "。UMI提取后,我们使用第二个阅读配对(40元)的所有后续分析。gydF4y2Ba
过滤后读取校准参考核糖体rna和图示,剩下的读取是对齐的转录组引用的单核苷酸多态性与Ns蒙面(有关详细信息,请参阅下一节);此后,我们仅仅保留了比对映射质量大于2。然后倒读,使用各自的umi一致相同的记录:“umi_tools dedup-per-contig-per-gene”。对于每个记录,我们清点的数量读取调整编码序列。我们使用Bowtie2 (ref。gydF4y2Ba64年gydF4y2Ba所有校准和SAMtools)gydF4y2Ba65年gydF4y2Ba1.11版本处理BAM文件。gydF4y2Ba
与多核糖体比较分析gydF4y2Ba
的成绩单验证polysomal胚胞阶段之间的联系和MII-stage卵母细胞的变化得到补充无花果。2和3的陈等。gydF4y2Ba18gydF4y2Ba。29的基因定量逆转录PCR-validated polysomal协会的变化,28岁的影响的报道方向当比较集中日志比率的均值(clr)gydF4y2Ba66年gydF4y2Ba在复制。具体地说,让gydF4y2Ba米gydF4y2Ba几何平均数的非零项,让所有的基因gydF4y2BaggydF4y2Ba是原始的数量为一个特定的基因。然后,clr的gydF4y2BaggydF4y2Ba是计算gydF4y2Barm \ ({\ {c}} {\ rm {l}} {\ rm {r}} (\ g) = {\ rm {l}} {\ rm {n}} \压裂{g} {M} \)gydF4y2Ba。gydF4y2Ba
RNA表达之间的关系和保利(A)尾巴长度gydF4y2Ba
以前,保利(A)尾长度在胚胞阶段小鼠卵母细胞测量使用短内容排序(TAIL-seq)gydF4y2Ba67年gydF4y2BaPacBio测序(PAIso-seq)gydF4y2Ba68年gydF4y2Ba。处理过的数据获得gydF4y2Bahttp://ftp.ebi.ac.uk/pub/databases/microcosm/tailseek/gydF4y2Ba和gydF4y2Bahttps://github.com/niehu2018/GV_oocyte_PAIsoSeqAnalysis/tree/master/resultsgydF4y2Ba。对于每一个基因,我们平均保利(A)尾测量在复制和转录。gydF4y2Ba
确定的影响益生元(dT)启动我们的RNA表达测量,我们重新进行唯一公开数据从小鼠受精卵没有使用保利(A)选择在其RNA测量(SUPeR-seq)gydF4y2Ba69年gydF4y2Ba。我们能够表达数据下载gydF4y2BaGSE53386gydF4y2Ba并计算平均每千碱基片段每百万映射读取从野生型小鼠受精卵在五个复制实验。我们量化RNA表达这些测量之间的差异和我们的使用日志gydF4y2Ba2gydF4y2Ba归一化值的比例。gydF4y2Ba
我们找到了一个非常弱的相关性测量聚(a)尾长度和RNA表达测量从胚胞阶段卵母细胞(斯皮尔曼相关PAIso-seq Tail-seq−0.04和0.07;扩展的数据图。gydF4y2Ba10 a, bgydF4y2Ba)。排除这样一种可能性,即观察弱相关可能是由于可靠性差的聚(A)尾部测量,我们比较PAIso-seq和Tail-seq测量,发现他们彼此中度相关的记录集测量不止一次(斯皮尔曼相关系数为0.42;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba)。gydF4y2Ba
尽管保利(A)尾长度没有系统地混淆测量RNA表达,丰富的成绩单和极短的聚(A)反面仍然可以被低估。事实上,基因子集的最短平均保利(A)尾长度(少于35元对应的最低1% PAIso-seq TAIL-seq和最低3.7%)显著降低了RNA表达测量(扩展数据图。gydF4y2Ba10 cgydF4y2Ba;Wilcoxon秩和检验gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba;扩展的数据图。gydF4y2Ba10 cgydF4y2Ba)。gydF4y2Ba
记录观察到的低表达与最短的聚(A)反面可能源于一个技术使用保利(A)选择的产物。另外,mrna的最短保利(A)反面可能本质上降低表达式。区分这两个选择,我们与SUPeR-seq相比我们的测量,这种方法不依赖于聚(a)的选择gydF4y2Ba69年gydF4y2Ba。正如预期的那样,SUPeR-seq测量高度与我们的测量(斯皮尔曼相关系数为0.82;gydF4y2BaPgydF4y2Ba< 2.2×10gydF4y2Ba−16gydF4y2Ba;扩展的数据图。gydF4y2Ba10 dgydF4y2Ba)。更重要的是,当比较两种方法之间的差异测量RNA丰富,只有最小协会作为保利(a)的函数尾部长度(扩展数据图。gydF4y2Ba10 egydF4y2Ba;克鲁斯卡尔-沃利斯排名和测试;gydF4y2BaPgydF4y2Ba0.016)的价值。gydF4y2Ba
在一起,这些结果表明,没有一个系统性偏差Smart-seq3-based RNA表达测量作为保利(a)尾长度的函数。然而,基因的表达与最短的聚(A)可能会略微低估了。gydF4y2Ba
之间的关系翻译效率和聚(A)尾长度gydF4y2Ba
小鼠胚胎早期的一个细胞,双因子和八细胞阶段以前用来确定聚(A)尾长度使用TAIL-seq的一个改良版本(gydF4y2Bahttps://doi.org/10.5281/zenodo.2640028gydF4y2Ba)gydF4y2Ba41gydF4y2Ba。这个HDF5文件包含标签的数量由聚聚合(A)尾长度。我们计算均值聚(A)尾长度使用说明每个基因的作者和rhdf5 2.42.0包版本(gydF4y2Bahttps://github.com/grimbough/rhdf5gydF4y2Ba)。gydF4y2Ba
为每个基因和胚胎阶段,我们首先计算核糖体密度的足迹和RNA-seq读取编码区域。这些值被规范化使用集中日志比率gydF4y2Ba66年gydF4y2Ba平均在复制。翻译效率的基因在胚胎阶段被定义为一个给定的比例正常化核糖体RNA表达入住率。翻译效率的引导置信区间计算抽样的替代复制Ribo-ITP RNA-seq实验和重复描述计算。gydF4y2Ba
Allele-specific核糖体入住率和RNA表达分析gydF4y2Ba
鉴于穿越菌株获得的小鼠胚胎在C57BL / 6 j(产妇),/ EiJ(父亲),我们使用已知的毒株特异性单核苷酸多态性确定父母的RNA分子。这允许我们决定核糖体占用或RNA表达的基因展品是母性或父性(即allele-specific)偏差如下详细。gydF4y2Ba
VCF格式的毒株特异性snp的列表了gydF4y2Bahttps://github.com/sandberg-lab/Smart-seq3/blob/master/allele_level_expression/CAST.SNPs.validated.vcf.gzgydF4y2Ba60gydF4y2Ba。我们提取210004不同的单核苷酸多态性,重叠记录注释。为了避免定位偏差,我们修改我们的转录组参考序列与Ns掩蔽SNP的位置。鼠标这个蒙面的转录组测序数据对齐参考。gydF4y2Ba
allele-specific分析,我们认为编码序列中的85339个snp的记录。鉴于成绩单在卵母细胞应该只包含孕产妇SNPs,我们使用的数据MII-stage卵母细胞来构建一个简单的误差修正模型。具体来说,2.67%和0.40%的读取包含non-maternal核糖体序列分析和RNA-seq实验,分别。这些值被用作估计测序误差百分比(错误)。gydF4y2Ba
我们定义的比率gydF4y2Ba
一个细胞八细胞胚胎,然后我们计算了error-corrected父亲的比率,gydF4y2Ba\ ({{\ rm{父亲}}}_ {{\ rm{纠正}}}\)gydF4y2Ba为:gydF4y2Ba
在那里,gydF4y2Ba\ ({{\ rm{父亲}}}_ {\ mathrm{观察}}\)gydF4y2Ba未修正的比例。我们得到这个方程从下面的模型假设下测序错误是随机:gydF4y2Ba
对于每个胚胎阶段,确定记录的父亲的比率显著不同的核糖体剖析与RNA-seq相比,我们首先聚合SNP-containing读取每个记录在复制。我们保留记录超过十读取核糖体剖析和RNA-seq实验包括至少三个父系和母系读取。我们使用两个示例测试比例平等的连续性校正(道具。测试在R;看到裁判的第三章。gydF4y2Ba70年gydF4y2Ba详情)。gydF4y2Ba
成绩单和95%置信区间的差异的比率(来自测试平等的比例),重叠的时间间隔(−0.05,0.05),被过滤掉。调整后的gydF4y2BaPgydF4y2Ba值使用错误发现率的方法,我们保留了记录与调整gydF4y2BaPgydF4y2Ba< 0.2。我们进一步删除记录的读取信息产业部阶段这些可能表明立场,容易对齐错误。作为最后一步,我们应用引导建立鲁棒性的结论。具体来说,我们随机抽样复制替换与重复上述统计测试过程。24错误发现率小于0.2的成绩单至少66 100引导样品被认为具有微分等位比率。总共有187编码区单核苷酸多态性分化的两个等位基因在这组24这些记录。这些snp的列表中提供了补充表gydF4y2Ba6gydF4y2Ba。gydF4y2Ba
图中描述的分析。gydF4y2Ba6gydF4y2Ba和扩展数据图。gydF4y2Ba9gydF4y2Ba,我们认为RNA表达数据从4个和八细胞胚胎阶段。我们丢弃基因少于十parent-of-origin区分读取所有复制给定的胚胎阶段。定义显示allele-specific偏见表达的基因,我们使用了一个引导的方法。对于每个样本,我们随机选择两个或四个复制替换4个和八细胞RNA表达数据,分别。读取被结合在复制和SNP的位置。基因被认为是来自父或母亲般地偏见如果paternal-to-maternal等位基因的比例支持读取超过70%在1000年至少有800的引导样品。其余的基因被认为是biallelic(或公正的)。总的来说,我们认为2239年和3707年biallelic, 191年和334年母亲般地偏见和103年和253年父亲一般地偏向基因在4个和八细胞阶段,分别。此外,37和47个基因表达的只有一个等位基因在4个和八细胞阶段,分别。这个子集的定义为monoallelic allele-specific基因。 Finally, to define a more high-confidence set of allele-biased genes, we required support from multiple SNPs such that the ratio of SNPs with\(\压裂{{\ rm{号码}}\;rm的{}}{\ \;rm{读取}}{\ \;rm{和}}{\ \;rm{父亲}}{\ \;{\ rm{等位基因}}+ 1}{{\ rm{号码}}\;rm的{}}{\ \;rm{读取}}{\ \;rm{和}}{\ \;rm{父亲}}{\ \;{\ rm{等位基因}}+ 1 + {\ rm{号码}}\;rm的{}}{\ \;rm{读取}}{\ \;rm{和}}{\ \;rm{孕产妇}}{\ \;{\ rm{等位基因}}+ 1}\)gydF4y2Ba> 0.5是至少60%。我们发现,195年和323年由多个snp基因支持4个和八细胞阶段,分别。比较的翻译效率分布不同的基因群,我们使用了非参数Wilcoxon等级和测试。估计效果的大小,我们报告褶皱变化定义为中值的比值的翻译效率allele-specific biallelic基因的基因。gydF4y2Ba
微分表达式和翻译效率分析gydF4y2Ba
读,对齐编码区域提取实验。确定记录最高的可变性在发育阶段,核糖体入住率variance-stabilizing转换(威仕特),如裁判所述。gydF4y2Ba71年gydF4y2Ba,应用于集中日志核糖体入住率比(“FindVariableFeatures”函数选择方法的“威仕特”修包v4 (ref。gydF4y2Ba72年gydF4y2Ba))。使用“vst.variance.standardized”阈值> 4.8,我们获得50个基因。gydF4y2Ba
连续每一对发育阶段,微分RNA表达和翻译效率决定使用DESeq2 (ref。gydF4y2Ba73年gydF4y2Ba)。微分翻译效率的计算中,我们使用术语之间的交互发展阶段和测量模式(核糖体分析或RNA-seq)。默认的参数用于阅读数归一化和gene-specific分散估计。影响大小进行适度使用广义线性模型近似后验估计gydF4y2Ba74年gydF4y2Ba。的调整gydF4y2BaPgydF4y2Ba截止值设置为0.01来确定一组转录RNA表达的显著变化和翻译效率。基因集富集分析基因本体术语进行了使用FuncAssociate (gydF4y2Bahttp://llama.mshri.on.ca/funcassociate/gydF4y2Ba),默认设置gydF4y2Ba75年gydF4y2Ba。gydF4y2Ba
RNA-seq和核糖体蛋白质组学数据和比较分析gydF4y2Ba
串联质量Tag-labelling-based丰富蛋白质组学数据为一个细胞morula-stage胚胎获得高et al。gydF4y2Ba6gydF4y2Ba。3287年三个模式都被用于测量蛋白质和被用于进一步分析。核糖体入住率和RNA表达被转换为密度除以读过数量的每个记录的长度编码区。这些值被规范化使用集中log-ratio转换为实现修v4 (ref。gydF4y2Ba72年gydF4y2Ba)。上述翻译效率被定义为。核糖体RNA表达之间的相似性,入住率,翻译效率和蛋白质丰度测量使用与斯皮尔曼等级相关的校正gydF4y2Ba76年gydF4y2Ba,gydF4y2Ba77年gydF4y2Ba。每个形态的测量可靠性估计使用复制来复制相关系数(核糖体分析效率为0.53,0.71,0.79,0.8 RNA-seq和质谱分析gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
加权转录区域长度分布gydF4y2Ba
文本区域、5′UTR cd和3′UTR加权区域长度的分布计算如下。首先,对于每个记录,我们决定区域长度记录长度的比率。接下来,我们这些比率与核糖体的数目增加入住率成绩单,给我们加权比例的地区。然后,对于每一个地区,我们计算加权比例的总和在记录。最后,让gydF4y2BawgydF4y2Ba5′UTRgydF4y2Ba,gydF4y2BawgydF4y2BacdgydF4y2Ba和gydF4y2BawgydF4y2Ba3′UTRgydF4y2Ba加权(gydF4y2BawgydF4y2Ba)的5′UTR区域,分别cd和3′UTR。对于一个地区gydF4y2BargydF4y2Ba、加权长度的百分比gydF4y2BargydF4y2Ba是gydF4y2Ba\ \(压裂{{w} _ {r}} {{w} _ {{5} ^ {{\ '}} {\ rm {UTR}}} + {w} _ {{\ rm {cd}}} + {w} _ {{3} ^ {{\ '}} {\ rm {UTR}}}} \乘以100。\)gydF4y2Ba
描述的SNP对allele-specific核糖体入住率的影响gydF4y2Ba
所有单核苷酸多态性分化孕产妇的父亲的等位基因等位基因提取与证据的记录集的微分allele-specific核糖体入住率(无花果。gydF4y2Ba4摄氏度gydF4y2Ba)。这些被他们的立场在注释记录(5′UTR、cd和3′UTR)和各种功能类如下详细使用bedtools版本v2.29.2 (ref。gydF4y2Ba78年gydF4y2Ba)以下选项:“bedtools相交wa世行”。gydF4y2Ba
单核苷酸多态性在5′utr被注解为候选生成翻译起始序列匹配9-nt序列围绕正则表达式的SNP ' [ATCG] + [AG] {1} [ATCG] {2} (ACG) {1} TG [AG] {1} (ATCG) + ' R基础::grepl。单核苷酸多态性的母亲或父亲的等位基因匹配的正则表达式。鼠标PD-31 FACS-seq数据报告的效率非规范翻译起始序列−4 + 4 (ref。gydF4y2Ba79年gydF4y2Ba)被用来评分候选人5′UTR起始位点的效率。gydF4y2Ba
分析RBP图案gydF4y2Ba
浓缩或损耗RBP七聚物图案是由石棉水泥板v1.16.0gydF4y2BakgydF4y2Ba- m记录设置主题分析方法gydF4y2Ba55gydF4y2Ba(Benjamini-HochberggydF4y2BaPgydF4y2Ba< 0.0001;补充表gydF4y2Ba5克ydF4y2Ba)和注释的点缀gydF4y2Ba56gydF4y2BaRBPs共识序列匹配七聚物。RBP点缀数据库中的同义词替换他们的标准基因名称(DAZ3:gydF4y2BaDAZLgydF4y2Ba;SF2:gydF4y2BaSRSF1gydF4y2Ba;B52:gydF4y2BaSRSF6gydF4y2Ba;Fusip1:gydF4y2BaSRSF10gydF4y2Ba;和ZNF326:gydF4y2BaZFP326gydF4y2Ba)。gydF4y2Ba
snp是交叉使用bedtools装饰图案的床上文件gydF4y2Ba78年gydF4y2Bav2.29.2后减去一个从床上开始协调以确保序列有相同的长度作为装饰位置权重矩阵。我们过滤102 1403个snp,相交RBP主题由于多个snp在近距离(少于5元)。父系和母系的序列中使用R v4.0.4点缀矩阵相似性得分。与多个位置权重矩阵,RBPs最大绝对差的分数计算是确定给定SNP主题影响最大的共识。然后,RBPs共享相同的主题和重叠共识SNP是倒塌成一个注释通过计算中位数差异分数。健壮的标准化执行的差异分数中值为(中心值,除以四分位范围)。单核苷酸多态性预测改变RBP绑定选择使用绝对的第95个百分位,标准化分数的区别。最后,RBPs丢弃如果他们没有鼠标同系物或者没有检测到表达在发展阶段分析(A1CF、棉子、ELAVL4 MSI1、KHDRBS3 PABPC5, RBM4B, TIA1, EIF4G2, RBFOX3, BRUNOL6, RBM23和SRSF8)。gydF4y2Ba
报告总结gydF4y2Ba
进一步研究信息设计是可用的gydF4y2Ba自然投资组合报告总结gydF4y2Ba与这篇文章有关。gydF4y2Ba
数据可用性gydF4y2Ba
测序文件核糖体在基因表达分析和RNA-seq实验综合(加入号码:gydF4y2BaGSE185732gydF4y2Ba)。点缀数据库文件被下载gydF4y2Bahttp://rnabiology.ircm.qc.ca/oRNAmentgydF4y2Ba(未指定的版本,下载2021年12月2日)的RBPsgydF4y2Ba亩骶gydF4y2Ba转录组。以下公共数据集用于本研究:gydF4y2BaGSE53386gydF4y2Ba,gydF4y2BaGSE78634gydF4y2Ba和gydF4y2BaGSE162060gydF4y2Ba。以前生成的聚(A)尾长度测量从下载gydF4y2Bahttp://ftp.ebi.ac.uk/pub/databases/microcosm/tailseek/gydF4y2Ba,gydF4y2Bahttps://github.com/niehu2018/GV_oocyte_PAIsoSeqAnalysis/tree/master/resultsgydF4y2Ba和gydF4y2Bahttps://doi.org/10.5281/zenodo.2640028gydF4y2Ba。VCF格式的毒株特异性snp的列表了gydF4y2Bahttps://github.com/sandberg-lab/Smart-seq3/blob/master/allele_level_expression/CAST.SNPs.validated.vcf.gzgydF4y2Ba。gydF4y2Ba
代码的可用性gydF4y2Ba
在这项研究中使用的代码是可用的gydF4y2Bahttps://github.com/CenikLab/ribo-itp_papergydF4y2Ba。gydF4y2Ba
引用gydF4y2Ba
Vastenhouw: L。,Cao, W. X. & Lipshitz, H. D. The maternal-to-zygotic transition revisited.发展gydF4y2Ba146年gydF4y2Badev161471 (2019)。gydF4y2Ba
张,C。,Wang, M., Li, Y. & Zhang, Y. Profiling and functional characterization of maternal mRNA translation during mouse maternal-to-zygotic transition.科学。睡觉。gydF4y2Ba8gydF4y2Baeabj3967 (2022)。gydF4y2Ba
王,问。,Chung, Y. G., deVries, W. N., Struwe, M. & Latham, K. E. Role of protein synthesis in the development of a transcriptionally permissive state in one-cell stage mouse embryos.医学杂志。天线转换开关。gydF4y2Ba65年gydF4y2Ba,748 - 754 (2001)。gydF4y2Ba
Lee m . T。,Bonneau, A. R. & Giraldez, A. J. Zygotic genome activation during the maternal-to-zygotic transition.为基础。启细胞Dev。杂志。gydF4y2Ba30.gydF4y2Ba,581 - 613 (2014)。gydF4y2Ba
李,L。,Zheng, P. & Dean, J. Maternal control of early mouse development.发展gydF4y2Ba137年gydF4y2Ba,859 - 870 (2010)。gydF4y2Ba
高,y . et al .蛋白表达小鼠在胚胎植入前胚胎发展的格局。gydF4y2Ba细胞的代表。gydF4y2Ba21gydF4y2Ba,3957 - 3969 (2017)。gydF4y2Ba
哦,B。,Hwang, S., McLaughlin, J., Solter, D. & Knowles, B. B. Timely translation during the mouse oocyte-to-embryo transition.发展gydF4y2Ba127年gydF4y2Ba,3795 - 3803 (2000)。gydF4y2Ba
Gebauer F。徐,W。,Cooper, G. M. & Richter, J. D. Translational control by cytoplasmic polyadenylation of c-mos mRNA is necessary for oocyte maturation in the mouse.EMBO J。gydF4y2Ba13gydF4y2Ba,5712 - 5720 (1994)。gydF4y2Ba
Ingolia: T。,Hussmann, J. A. & Weissman, J. S. Ribosome profiling: global views of translation.冷泉哈布。教谕。医学杂志。gydF4y2Ba11gydF4y2Baa032698 (2019)。gydF4y2Ba
Ingolia: T。,Ghaemmaghami, S., Newman, J. R. S. & Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling.科学gydF4y2Ba324年gydF4y2Ba,218 - 223 (2009)。gydF4y2Ba
Rogacs,。,米一个rshall, L. A. & Santiago, J. G. Purification of nucleic acids using isotachophoresis.j . Chromatogr。一个gydF4y2Ba1335年gydF4y2Ba,105 - 120 (2014)。gydF4y2Ba
Schoch, r . B。,Ronaghi, M. & Santiago, J. G. Rapid and selective extraction, isolation, preconcentration, and quantitation of small RNAs from cell lysate using on-chip isotachophoresis.芯片实验室gydF4y2Ba9gydF4y2Ba,2145 - 2152 (2009)。gydF4y2Ba
Khnouf, R。,Han, C. M. & Munro, S. A. Isolation of enriched small RNA from cell-lysate using on-chip isotachophoresis.电泳gydF4y2Ba40gydF4y2Ba,3140 - 3147 (2019)。gydF4y2Ba
汉族,c . m . et al。同时RNA净化和大小选择使用片上等速电泳离子垫片。gydF4y2Ba芯片实验室gydF4y2Ba19gydF4y2Ba,2741 - 2749 (2019)。gydF4y2Ba
开斋节,c &圣地亚哥,j·g·等速电泳应用于生物分子反应。gydF4y2Ba芯片实验室gydF4y2Ba18gydF4y2Ba11-26 (2017)。gydF4y2Ba
Abdel-Sayed, P。,Yamauchi, K. A., Gerver, R. E. & Herr, A. E. Fabrication of an open microfluidic device for immunoblotting.肛交。化学。gydF4y2Ba89年gydF4y2Ba,9643 - 9648 (2017)。gydF4y2Ba
McGlincy: j . & Ingolia n . t . Transcriptome-wide测量核糖体翻译的分析。gydF4y2Ba方法gydF4y2Ba126年gydF4y2Ba,112 - 129 (2017)。gydF4y2Ba
陈,j . et al。翻译的全基因组分析揭示了一个关键角色删除azoospermia-like (Dazl) oocyte-to-zygote过渡。gydF4y2BaDev的基因。gydF4y2Ba25gydF4y2Ba,755 - 766 (2011)。gydF4y2Ba
邓,Q。,Ramsköld, D., Reinius, B. & Sandberg, R. Single-cell RNA-seq reveals dynamic, random monoallelic gene expression in mammalian cells.科学gydF4y2Ba343年gydF4y2Ba,193 - 196 (2014)。gydF4y2Ba
Santini, l . et al .基因组印记在小鼠胚泡主要是与H3K27me3有关。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba3804 (2021)。gydF4y2Ba
Hagemann-Jensen, m . et al .单细胞RNA计算等位基因和同种型使用Smart-seq3决议。gydF4y2Ba生物科技Nat。》。gydF4y2Ba38gydF4y2Ba,708 - 714 (2020)。gydF4y2Ba
福田康夫的k . et al .要求3′-UTR-dependent抑制DAZL卵母细胞的胚胎植入前鼠标的发展。gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba14gydF4y2Bae1007436 (2018)。gydF4y2Ba
杨,C.-R。et al。rna结合蛋白DAZL功能抑制因子和活化剂的信使核糖核酸的翻译在卵母细胞成熟。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba1399 (2020)。gydF4y2Ba
陈,d . et al . Pumilio 1抑制多种催化剂的p53保护精子发生。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba22gydF4y2Ba,420 - 425 (2012)。gydF4y2Ba
林,k . et al。哺乳动物的胚胎发育Pumilio家庭的基本需求。gydF4y2Ba摩尔。杂志。细胞gydF4y2Ba29日gydF4y2Ba,2922 - 2932 (2018)。gydF4y2Ba
门德斯,r . et al . CPE的磷酸化绑定c-mos mRNA Eg2调节翻译的因素。gydF4y2Ba自然gydF4y2Ba404年gydF4y2Ba,302 - 307 (2000)。gydF4y2Ba
Maslon, M . M。,Heras, S. R., Bellora, N., Eyras, E. & Cáceres, J. F. The translational landscape of the splicing factor SRSF1 and its role in mitosis.eLifegydF4y2Ba3gydF4y2Bae02028 (2014)。gydF4y2Ba
Wethmar, k上游的管理潜力开放阅读框架在真核基因表达。gydF4y2Ba威利Interdiscip。启RNAgydF4y2Ba5克ydF4y2Ba,765 - 778 (2014)。gydF4y2Ba
长冈,我美国。,Hassold, T. J. & Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem.Nat,启麝猫。gydF4y2Ba13gydF4y2Ba,493 - 504 (2012)。gydF4y2Ba
施耐德,i & Ellenberg j .胚胎发育的奥秘:如何错误频繁出现在哺乳动物的生活?gydF4y2Ba公共科学图书馆杂志。gydF4y2Ba17gydF4y2Bae3000173 (2019)。gydF4y2Ba
Ajduk,。,年代tr一个uss, B., Pines, J. & Zernicka-Goetz, M. Delayed APC/C activation extends the first mitosis of mouse embryos.科学。代表。gydF4y2Ba7gydF4y2Ba9682 (2017)。gydF4y2Ba
Kwon J。,Jo, Y.-J., Namgoong, S. & Kim, N.-H. Functional roles of hnRNPA2/B1 regulated by METTL3 in mammalian embryonic development.科学。代表。gydF4y2Ba9gydF4y2Ba8640 (2019)。gydF4y2Ba
伊万诺娃,et al . m RNAgydF4y2Ba6gydF4y2Ba读者YTHDF2 assential为孕产妇转录组和卵母细胞的转录后调控能力。gydF4y2Ba摩尔。细胞gydF4y2Ba67年gydF4y2Ba,1059 - 1067。e4 (2017)。gydF4y2Ba
赵,b s等人gydF4y2Ba6gydF4y2Ba依赖孕产妇mRNA间隙促进斑马鱼maternal-to-zygotic过渡。gydF4y2Ba自然gydF4y2Ba542年gydF4y2Ba,475 - 478 (2017)。gydF4y2Ba
Kasowitz, s . d . et al .核mgydF4y2Ba6gydF4y2Ba一位读者YTHDC1调节可变聚腺苷酸化和拼接在小鼠卵母细胞的发展。gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba14gydF4y2Bae1007412 (2018)。gydF4y2Ba
郑,g . et al . ALKBH5是哺乳动物影响核糖核酸RNA demethylase新陈代谢和老鼠的生育能力。gydF4y2Ba摩尔。细胞gydF4y2Ba49gydF4y2Ba29 (2013)。gydF4y2Ba
科利尔,B。,Gorgoni, B., Loveridge, C., Cooke, H. J. & Gray, N. K. The DAZL family proteins are PABP-binding proteins that regulate translation in germ cells.EMBO J。gydF4y2Ba24gydF4y2Ba,2656 - 2666 (2005)。gydF4y2Ba
斯特里克兰,s . et al .反义RNA针对3′非编码区域防止休眠mRNA在小鼠卵母细胞激活。gydF4y2Ba科学gydF4y2Ba241年gydF4y2Ba,680 - 684 (1988)。gydF4y2Ba
威尔,L。,Belloc, E., Bava, F.-A. & Méndez, R. Translational control by changes in poly(A) tail length: recycling mRNAs.Nat。结构。摩尔。杂志。gydF4y2Ba19gydF4y2Ba,577 - 585 (2012)。gydF4y2Ba
Subtelny, a . O。,Eichhorn, S. W., Chen, G. R., Sive, H. & Bartel, D. P. Poly(A)-tail profiling reveals an embryonic switch in translational control.自然gydF4y2Ba508年gydF4y2Ba,66 - 71 (2014)。gydF4y2Ba
Chang h . et al .终端uridylyltransferases执行程序间隙的孕产妇转录组在脊椎动物的胚胎。gydF4y2Ba摩尔。细胞gydF4y2Ba70年gydF4y2Ba,72 - 82。e7(2018)。gydF4y2Ba
Passmore、洛杉矶和科勒,j . mRNA保利(A)反面的角色在真核基因表达调控。gydF4y2BaNat。启摩尔。细胞杂志。gydF4y2Ba23gydF4y2Ba,93 - 106 (2022)。gydF4y2Ba
香,k & Bartel d p的分子基础poly (A)多边形之间的耦合长度和转化效率。gydF4y2BaeLifegydF4y2Ba10gydF4y2Bae66493 (2021)。gydF4y2Ba
以色列、美国等。一个集成的全基因组multi-omics分析胚胎植入前的基因表达动态的老鼠胚胎。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba13356 (2019)。gydF4y2Ba
Tucci, V。,Isles, A. R., Kelsey, G. & Ferguson-Smith, A. C. & Erice Imprinting Group. Genomic imprinting and physiological processes in mammals.细胞gydF4y2Ba176年gydF4y2Ba,952 - 965 (2019)。gydF4y2Ba
Surani m a &巴顿,s . c . gynogenetic鸡蛋放在鼠标的发展:对孤雌生殖的胚胎。gydF4y2Ba科学gydF4y2Ba222年gydF4y2Ba,1034 - 1036 (1983)。gydF4y2Ba
Surani, m·A。,Barton, S. C. & Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis.自然gydF4y2Ba308年gydF4y2Ba,548 - 550 (1984)。gydF4y2Ba
麦格拉思,j . &你d完成小鼠胚胎发生需要父系和母系的基因组。gydF4y2Ba细胞gydF4y2Ba37gydF4y2Ba,179 - 183 (1984)。gydF4y2Ba
Surani m a基因组印记:控制基因表达的表观遗传继承。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba6gydF4y2Ba,390 - 395 (1994)。gydF4y2Ba
DeVeale B。,van der Kooy, D. & Babak, T. Critical evaluation of imprinted gene expression by RNA-seq: a new perspective.公共科学图书馆麝猫。gydF4y2Ba8gydF4y2Bae1002600 (2012)。gydF4y2Ba
VanInsberghe, M。,van den Berg, J., Andersson-Rolf, A., Clevers, H. & van Oudenaarden, A. Single-cell Ribo-seq reveals cell cycle-dependent translational pausing.自然gydF4y2Ba597年gydF4y2Ba,561 - 565 (2021)。gydF4y2Ba
Cenik e . s . et al .孕产妇核糖体足以组织多样化在胚胎发育期间gydF4y2Ba秀丽隐杆线虫gydF4y2Ba。gydF4y2BaDev细胞。gydF4y2Ba48gydF4y2Ba,811 - 826。e6 (2019)。gydF4y2Ba
Peshkin l . et al .,蛋白质和mRNA动力学的关系在脊椎动物胚胎发育。gydF4y2BaDev细胞。gydF4y2Ba35gydF4y2Ba,383 - 394 (2015)。gydF4y2Ba
贝克尔,k . et al .量化转录后调控的发展gydF4y2Ba黑腹果蝇gydF4y2Ba。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba4970 (2018)。gydF4y2Ba
Krismer k . et al .石棉水泥板:计算motif-based分析平台,确定rna结合蛋白调节基因表达的变化。gydF4y2Ba细胞的代表。gydF4y2Ba32gydF4y2Ba108064 (2020)。gydF4y2Ba
Benoit Bouvrette, l . P。、Bovaird年代。,Blanchette, M. & Lécuyer, E. oRNAment: a database of putative RNA binding protein target sites in the transcriptomes of model species.核酸Res。gydF4y2Ba48gydF4y2BaD166-D173 (2020)。gydF4y2Ba
绿色,m . r . & Sambrook j .隔离的DNA片段聚丙烯酰胺凝胶的粉碎和浸泡法。gydF4y2Ba冷泉哈布。Protoc。gydF4y2Bahttps://doi.org/10.1101/pdb.prot100479gydF4y2Ba(2019)。gydF4y2Ba
Takeo t & Nakagata:防冷冻的媒介代理包含组合gydF4y2BalgydF4y2Ba谷氨酰胺和methyl-β-cyclodextrin预培养中产生一个高低温贮藏C57BL / 6 j小鼠精子的受精率。gydF4y2Ba实验室。。gydF4y2Ba44gydF4y2Ba,132 - 137 (2010)。gydF4y2Ba
Takeo t & Nakagata:谷胱甘肽增强生育能力降低冷冻/解冻C57BL / 6小鼠精子接触methyl-β-cyclodextrin之后。gydF4y2Ba医学杂志。天线转换开关。gydF4y2Ba85年gydF4y2Ba,1066 - 1072 (2011)。gydF4y2Ba
Hagemann-Jensen, m . et al .单细胞RNA计算等位基因和同种型使用Smart-seq3决议。gydF4y2Ba生物科技Nat。》。gydF4y2Ba38gydF4y2Ba,708 - 714 (2020)。gydF4y2Ba
Ozadam, H。,Geng, M. & Cenik, C. RiboFlow, RiboR and RiboPy: an ecosystem for analyzing ribosome profiling data at read length resolution.生物信息学gydF4y2Ba36gydF4y2Ba,2929 - 2931 (2020)。gydF4y2Ba
史密斯,T。,Heger, A. & Sudbery, I. UMI-tools: modeling sequencing errors in unique molecular identifiers to improve quantification accuracy.基因组Res。gydF4y2Ba27gydF4y2Ba,491 - 499 (2017)。gydF4y2Ba
马丁,m . Cutadapt删除适配器从高通量测序序列读取。gydF4y2BaEMBnet.journalgydF4y2Ba17gydF4y2Ba10 - 12 (2011)。gydF4y2Ba
Langmead, b &扎尔茨贝格,s . l .快gapped-read符合领结2。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba,357 - 359 (2012)。gydF4y2Ba
Danecek, p . et al .十二年SAMtools BCFtools。gydF4y2BaGigasciencegydF4y2Ba10gydF4y2Bagiab008 (2021)。gydF4y2Ba
奎因,t . P。,我Erb。,Richardson, M. F. & Crowley, T. M. Understanding sequencing data as compositions: an outlook and review.生物信息学gydF4y2Ba34gydF4y2Ba,2870 - 2878 (2018)。gydF4y2Ba
摩根先生等人mRNA 3′uridylation和保利(A)尾长度雕刻哺乳动物孕产妇转录组。gydF4y2Ba自然gydF4y2Ba548年gydF4y2Ba,347 - 351 (2017)。gydF4y2Ba
刘,Y。,N我e,H., Liu, H. & Lu, F. Poly(A) inclusive RNA isoform sequencing (PAIso-seq) reveals wide-spread non-adenosine residues within RNA poly(A) tails.Commun Nat。gydF4y2Ba10gydF4y2Ba5292 (2019)。gydF4y2Ba
粉丝,x et al .单细胞RNA-seq线性和环形rna的转录组分析小鼠胚胎植入前的胚胎。gydF4y2Ba基因组医学杂志。gydF4y2Ba16gydF4y2Ba148 (2015)。gydF4y2Ba
弗莱斯,j·L。gydF4y2Ba统计方法对利率和比例gydF4y2Ba(威利,2003)。gydF4y2Ba
哈夫迈斯特,c & Satija r .规范化和方差稳定化的单细胞RNA-seq数据使用正规化负二项回归。gydF4y2Ba基因组医学杂志。gydF4y2Ba20.gydF4y2Ba296 (2019)。gydF4y2Ba
,y . et al .集成多通道单细胞分析数据。gydF4y2Ba细胞gydF4y2Ba184年gydF4y2Ba,3573 - 3587。e29 (2021)。gydF4y2Ba
爱,我。,Huber, W. & Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2.基因组医学杂志。gydF4y2Ba15gydF4y2Ba550 (2014)。gydF4y2Ba
朱,。,Ibrahim, J. G. & Love, M. I. Heavy-tailed prior distributions for sequence count data: removing the noise and preserving large differences.生物信息学gydF4y2Ba35gydF4y2Ba,2084 - 2092 (2019)。gydF4y2Ba
Berriz, g F。,Beaver, J. E., Cenik, C., Tasan, M. & Roth, F. P. Next generation software for functional trend analysis.生物信息学gydF4y2Ba25gydF4y2Ba,3043 - 3044 (2009)。gydF4y2Ba
Csardi G。,Franks, A., Choi, D. S., Airoldi, E. M. & Drummond, D. A. Accounting for experimental noise reveals that mRNA levels, amplified by post-transcriptional processes, largely determine steady-state protein levels in yeast.公共科学图书馆麝猫。gydF4y2Ba11gydF4y2Bae1005206 (2015)。gydF4y2Ba
枪兵,c的证明和测量两点之间的联系。gydF4y2Ba点。j . Psychol。gydF4y2Ba15gydF4y2Ba,72 - 101 (1904)。gydF4y2Ba
昆兰,a。r . &大厅,i m . BEDTools:一套灵活的工具来比较基因组的特性。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba,841 - 842 (2010)。gydF4y2Ba
迪亚兹·德·阿尔塞a·J。,Noderer, W. L. & Wang, C. L. Complete motif analysis of sequence requirements for translation initiation at non-AUG start codons.核酸Res。gydF4y2Ba46gydF4y2Ba,985 - 994 (2018)。gydF4y2Ba
确认gydF4y2Ba
我们感谢w . Shawlot和老鼠基因工程设施标准以内的贡献;和a·约翰逊,s . Vokes b Cenik和大肠Sarinay Cenik手稿的关键评估。某些商业设备、仪器或材料确定本文充分指定实验过程。这样的身份并不打算意味着推荐或认可的国家标准与技术研究院(NIST),也不是有意暗示标识的材料或设备必然是最好的可用的目的。这项工作是由国家卫生研究院的基金支持部分CA204522 HD110096,和韦尔奇基金会林祖嘉林祖嘉f - 2027 - 20200401是CPRIT学者支持癌症研究CPRIT格兰特RR180042。C.M.H.承认NIST NRC博士后为准会员的支持项目和NIST联合倡议的支持在斯坦福大学生物学计量。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
H.O.,T。T。C.M.H.,林祖嘉参与了原稿。H.O.,T。T。,C.M.H.,I.H.共和国,, M.S. and C.C. participated in reviewing and editing the manuscript. C.M.H., M.S. and C.C. conceptualized the study design. H.O., T.T., A.S., I.H. and C.C. generated the figures for the manuscript. C.M.H. and C.C. designed the Ribo-ITP chip and enabled on-chip polyacrylamide polymerization with help from D.C. Gel concentrations were optimized by T.T. and C.C. T.T. performed and analysed size selection and RNA yield experiments, optimized RNA digestion conditions for Ribo-ITP, performed Ribo-ITP and library preparation of mouse and 100-cell K562 samples, and performed mouse RNA-seq experiments. A.S., V.G. and S.R. performed Ribo-ITP and library preparation of single-cell K562 samples. C.M.H. and D.T. optimized the collection procedure of Ribo-ITP through conductivity and pH experiments. H.O. and C.C. formally analysed all Ribo-ITP and RNA-seq data, and performed quality control analysis of sequencing data, differential translation efficiency and protein abundance analyses. H.O. developed the RNA-seq analysis pipeline, processed all the sequencing data, developed the SNP analysis software and performed allele-specific analyses. I.H. conducted the RBP analysis. C.C. provided study oversight and acquired funding. All authors approved the final manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
美国专利申请号63/286,531名为核糖体通过等速电泳分析的贝和C.M.H.、国际专利申请号PCT / US2022/080982基于我们序列号。63/286,531名为“核糖体通过等速电泳分析”林祖嘉也申请了C.M.H.评议委员会的名义,德州大学系统等。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然gydF4y2Ba感谢匿名评论者对他们的贡献的同行评审工作。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
扩展数据数据和表gydF4y2Ba
扩展数据图1 Ribo-ITP设计使高效RNA提取和大小选择。gydF4y2Ba
一个gydF4y2Ba的顶视图ITP芯片布局设计与SOLIDWORKS(单位毫米)。信道特性的厚度是375µm和矩形的基础是1.5毫米。应用线性逐渐减少矩形基础的外缘(圆角矩形)。gydF4y2BabgydF4y2Ba微流控设备安装;指示溶解产物、提取和尺寸选择渠道;落后于电解质(TE)和主要的电解质(LE)水库;和洗脱。缓冲区对应于每个通道和储集层是颜色编码。标记寡核苷酸荧光用绿色。gydF4y2BacgydF4y2Ba凝胶图像显示中使用荧光标记的相对机动性Ribo-ITP (M)随着Zymo研究R1090小RNA梯(Z)和合成RNA寡核苷酸(S) (n = 1)。gydF4y2BadgydF4y2Ba,鉴于pH值的关键因素决定去磷酸化效率,我们确定的影响Ribo-ITP收集导电性和pH值的去磷酸化缓冲区。我们发现微不足道的pH值变化(右轴,蓝色),只有11.0%±1.83% (SEM)电导率的变化(左轴、绿)收集距离(5毫米,用垂直线)用于Ribo-ITP。gydF4y2BaegydF4y2Ba,代表凝胶图像的控制输入(I), Ribo-ITP洗脱(R)和凝胶萃取(G)样本。四个RNA物种(17日、21日、25和29元)是用于总输入20和40 ng。荧光标记寡核苷酸被上升到控制和凝胶凝胶可视化之前提取样品。gydF4y2BafgydF4y2Ba凝胶图像的量化控制输入(灰色),Ribo-ITP洗脱(橙色)和凝胶萃取(紫色)样品(n = 4)。最小、最大和平均所代表的值是盒子和单杠。只有25和29元RNA乐队标志被量化的收益计算。gydF4y2BaggydF4y2Ba输入(我灰色)准备通过增加40 ng的RNA从~ 1000 K562细胞溶解产物。RNA由四个物种从17到29元的长度。添加了荧光标记dna Ribo-ITP样本(R)除了EGTA(10毫米)。RNA提取和分离是完成Ribo-ITP其次是可视化使用凝胶电泳。gydF4y2BahgydF4y2Ba,产量25和29元rna是量化和绘制两个复制(84%和91%)。gydF4y2Ba
扩展数据图2对比Ribo-ITP核糖体和常规分析。gydF4y2Ba
Ribo-ITP实验~ 100 -细胞相比,传统的核糖体剖析~ 10 m细胞板。gydF4y2Ba一个gydF4y2Ba、成绩单和至少一个计数每百万(cpm)至少三分之二的复制被选中。日志gydF4y2Ba2gydF4y2Ba平均cpm(轴)策划的平方根的标准差cpm(轴)。绿色(Ribo-ITP)和红色(传统)点代表个人记录日志gydF4y2Ba2gydF4y2Ba(cpm) > 2。gydF4y2BabgydF4y2Ba剪读取的百分比,映射到使用RiboFlow核糖体rna进行了计算gydF4y2Ba61年gydF4y2Ba。均值和标准误差(n = 3;参见补充表gydF4y2Ba1gydF4y2Ba)。gydF4y2BacgydF4y2Bametagene情节,位置0开始对应(左,亮绿色)或停止(对,深绿色)网站。根据其网站调整补偿核糖体脚印。为每个方法是绘制一个代表复制。gydF4y2BadgydF4y2Ba,具体的平均百分比读总映射读取策划之间的长度。带线表示平均数标准误差。gydF4y2BaegydF4y2Ba,核糖体的百分比分析读取映射到cd为每个实验(左)表示。单个细胞K562细胞生成的数据使用我核糖核酸酶消化(1 - 1、1 - 2、1 - 3)或MNase (1 - 4、1 - 5)。加权数的总和在记录绘制了比较(右)。加权求和计算为每个记录的总数乘以其区域长度核糖体的脚印。gydF4y2BafgydF4y2Ba,核糖体的足迹从Ribo-ITP和常规方法被用来计算的平均分数读取映射到每一个阅读框(方法)。误差的平均数标准误差表示复制。gydF4y2Ba
扩展数据图3为单细胞和单胚胎的测量质量控制核糖体入住率和RNA表达。gydF4y2Ba
一个gydF4y2Ba,读取的数量(轴)策划对检测到的基因的数量(轴)。三个代表复制显示为每个发展阶段用于单个细胞核糖体和分析实验gydF4y2BaGSE162060gydF4y2Ba(Pro02_TCGTCAGTAC Pro05_CCAATCCAGG和Dis01_TCGCTCTGCT)。三个老鼠细胞突出显示gydF4y2BaGSE162060gydF4y2Ba被选来代表平均覆盖率的研究。检测到基因总数使用所有cd映射读取显示随着基因检测为1.25 k, 2.5 k, 5 k, 10 k, 20 k, 30 k和40 k umi业者进行编码区域映射。插图图显示的放大版本相同的数据在x轴从0到5公里。gydF4y2BabgydF4y2Ba,核糖体的足迹从n = 15单细胞Ribo-ITP样本问,信息产业部和1-cell阶段被用来计算读取的一部分映射到每一个阅读框(方法)。误差的平均数标准误差表示复制。gydF4y2BacgydF4y2Ba,Metagene块翻译启动和停止网站代表RNA-Seq实验。与核糖体性能分析数据,没有可检测峰观察到翻译启动或停止网站。gydF4y2BadgydF4y2Ba,Metagene块翻译启动和停止网站代表Ribo-ITP实验使用有或4细胞阶段老鼠胚胎。启动网站(亮绿色(左)和停止网站(深绿色)在位置0轴。对齐的位置读取调整根据他们网站补偿。gydF4y2BaegydF4y2Ba,CDS-mapping阅读数量从每个记录被用来计算斯皮尔曼相关系数。Ribo-ITP(橙色)和RNA-Seq(蓝色)实验是有序的发展阶段。显示的颜色强度的相关性。gydF4y2Ba
扩展数据图4核糖体入住率在全球之声,MII-stages成绩单与之前已经确定微分多核糖体协会。gydF4y2Ba
一个gydF4y2Ba的意思是集中log-ratio核糖体的入住率(轴)绘制平均数标准误差。这些记录被确认增加多核糖体协会MII-stage GV-stage相比gydF4y2Ba18gydF4y2Ba。gydF4y2BabgydF4y2Ba,类似于小组除了这些记录被发现显示多核糖体减少协会MII-stage GV-stage相比gydF4y2Ba18gydF4y2Ba。gydF4y2BacgydF4y2Ba、日志gydF4y2Ba2gydF4y2Ba翻译效率比(核糖体RNA表达入住率/)强调MII期卵母细胞相比,全球之声的基因是策划以及它们的标准误差。竖线分隔的基因在面板gydF4y2Ba一个gydF4y2Ba从gydF4y2BabgydF4y2Ba。gydF4y2Ba
扩展数据图5 Allele-specific核糖体入住率和RNA表达。gydF4y2Ba
一个gydF4y2Ba重叠,从RNA-seq读取实验毒株特异性snp是用来确定读取的比例相匹配的产妇(绿色)和父亲的(红色)等位基因。一小部分读取不同的等位基因,并标记为“其他”(深蓝色)。gydF4y2BabgydF4y2Ba核糖体的足迹从Ribo-ITP实验作为在面板。gydF4y2BacgydF4y2BaRNA序列读取的百分比,来自父亲的等位基因是可视化基因至少10 allele-specific读取在每个阶段。gydF4y2BadgydF4y2Ba,核糖体足迹的比例分配给父亲的等位基因是绘制在面板组基因c。gydF4y2Ba
扩展数据图6代表基因allele-specific核糖体入住率和RNA表达的不同。gydF4y2Ba
线图(上)显示父亲的读取(轴)的平均百分比RNA-Seq和Ribo-ITP实验。读相结合在复制和误差表明平均数标准误差的父亲的比率。在底部,产假和陪产读计数每10 k绘制个人复制和单核苷酸多态性。的总数检测编码单核苷酸多态性及其对应的颜色与所示。每个竖线对应于一个复制实验。gydF4y2Ba一个gydF4y2Ba与没有区别,代表基因等位基因——特定的核糖体RNA表达相比入住率。gydF4y2BabgydF4y2Ba,我代表基因集群(图。gydF4y2Ba4gydF4y2Ba)。gydF4y2BacgydF4y2Ba从集群II(图,代表基因。gydF4y2Ba4gydF4y2Ba)。gydF4y2BadgydF4y2Ba第三,代表基因集群(无花果。gydF4y2Ba4gydF4y2Ba等位基因)和延迟的参与核糖体,stage-specific方式即父母的RNA表达观察到或之前4 -细胞阶段,然而,这些RNA主要参与核糖体只在为舞台。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba第四,代表基因集群(无花果。gydF4y2Ba4gydF4y2Ba)。gydF4y2Ba
扩展数据图7微分RBP图案的转化效率和浓缩阶段卵母细胞和胚胎发育。gydF4y2Ba
一个gydF4y2Ba,点缀矩阵相似性得分gydF4y2Ba56gydF4y2Ba计算了父系和母系snp相交RBP图案,和马克斯绝对差的分数决定。SNP-motifs在第95百分位的绝对差异显示。一个积极的区别(黄色)表示的SNP更紧密地匹配RBP主题,而负差异(蓝色)显示一个更好的匹配的孕产妇SNP。RBPs共有一个图案是用逗号分隔的。SNP坐标是相对于mm10构建。gydF4y2BabgydF4y2Ba示意图的预测上游开放阅读框(uORF)gydF4y2BaTmppegydF4y2Ba。uORF值和强度填补表示相应的非规范的效率从老鼠PD-31细胞翻译起始位点gydF4y2Ba79年gydF4y2Ba。gydF4y2BacgydF4y2Ba,allele-specific读入核糖体的平均比率分析(n = 4) RNA-seq (n = 4)后被绘制在snp聚合数据和实验。每个实验规范化10 k SNP-informative读取dna测序深度的差异。误差线对应的80%置信区间计算使用引导抽样复制。pseudocount 0.5添加了规范化RNA-seq和核糖体分析计算。gydF4y2Bad、e、gydF4y2Ba火山的情节描述统计学意义(轴)和日志gydF4y2Ba2gydF4y2Ba叠化(轴)之间的转换效率之间的全球之声——MII-stage卵母细胞和有4细胞阶段的胚胎。紫色和蓝色的点显示转录与翻译效率之间的显著差异而阶段(罗斯福< 0.01)。gydF4y2BafgydF4y2Ba、浓缩和损耗的RBP图案之间的基因与增加TE MII和问阶段由石棉水泥板决定gydF4y2Ba55gydF4y2Ba(Benjamini-Hochberg调整p值< 0.0001,补充表gydF4y2Ba5克ydF4y2Ba)和注释的点缀gydF4y2Ba56gydF4y2BaRBPs。RBPs,共享相同的图案是用逗号分隔的共识,和RBPs没有检测到表达都标有星号。gydF4y2Ba
扩展数据图8 RNA表达之间的关系,翻译和蛋白质丰度在胚胎阶段。gydF4y2Ba
一个gydF4y2Ba,维恩图之间的重叠设置减少RNA的转录丰度或转化效率在受精(MII-oocyte受精卵转变)。gydF4y2BabgydF4y2Ba,意思是保利(A)尾长度和翻译效率计算使用的数据都有阶段胚胎(n = 3 Ribo-ITP;n = 4 RNA-Seq;见的方法)。框对应四分位范围和水平线表示中位数。gydF4y2BacgydF4y2Ba,意味着翻译效率及其90%置信区间绘制PABPC1连同它的意思是保利(A)长度1-cell (n = 5 Ribo-ITP;n = 4 RNA-Seq)和有胚胎。gydF4y2Bad, e, fgydF4y2Ba,蛋白质丰度和之间的两两相关gydF4y2BadgydF4y2Ba,RNA表达或gydF4y2BaegydF4y2Ba、核糖体占用或gydF4y2BafgydF4y2Ba,翻译效率。斯皮尔曼相关系数与斯皮尔曼的校正报告内的热图。gydF4y2Bag hgydF4y2Ba桑基图描述翻译效率和蛋白质丰度之间的关系。颜色和路径连接节点的厚度与相关系数成正比。gydF4y2Ba
扩展数据图9翻译效率与allelic-biased RNA的基因表达。gydF4y2Ba
所有情节,箱子对应四分位范围和水平线表示中位数。铰链的胡须扩展最多四分位范围的1.5倍。假定值计算使用双面Wilcoxon等级和测试。核糖体翻译效率被定义为平均入住率(MII n = 5, 1-cell n = 5, 4细胞n = 3,为n = 4)除以平均RNA表达(MII n = 4, 1-cell n = 4, 4细胞n = 2,为n = 4)gydF4y2Ba一个gydF4y2Ba,翻译效率是绘制两个bi-allelic基因(gydF4y2BaAnapc7gydF4y2Ba和gydF4y2BaPlpp5gydF4y2Ba),两个母亲般地偏见基因(gydF4y2BaTescgydF4y2Ba和gydF4y2BaTubg2gydF4y2Ba)和两个父亲一般地偏向基因(gydF4y2BaPrkczgydF4y2Ba和gydF4y2BaShc3gydF4y2Ba)。垂直条指示引导样本的95%置信区间变化翻译效率。水平线描述所有bi-allelic基因的平均转换效率。gydF4y2BabgydF4y2Ba,翻译效率无偏(bi-allelic),从父本和母本基因绘制抱有偏见。gydF4y2BacgydF4y2Ba,我们定义一组高信任度的allelic-biased成绩单是由多个SNP(方法)。散点图,左边显示了父亲的比率4细胞的基因(轴)和8芯(轴)阶段。等位基因是彩色的偏见和无偏灰色基因是彩色的。gydF4y2BadgydF4y2Ba用于选择,一个最近邻匹配方法的一个子集bi-allelic基因匹配的RNA的分布表达式和cd长度相比allele-specific基因(方法)。gydF4y2Bae, fgydF4y2Ba4细胞,allele-biased表达的基因,为阶段相比其他基因对他们的翻译效率1-cell和信息产业部阶段。bi-allelic基因匹配allele-specific对RNA表达水平和cd的长度。gydF4y2Bag hgydF4y2Ba对于每个记录中,x轴表示平均RPKM RNA-seq和y轴是相应的意思翻译效率。与等位基因表达偏见是彩色的。gydF4y2Ba
扩展数据图10 RNA表达测量使用Smart-seq3不表现出系统性偏差作为保利(a)尾长度的函数。gydF4y2Ba
保利(A)从老鼠尾巴的长度记录GV-stage卵母细胞从两个检索先前的研究gydF4y2Ba一个gydF4y2BaTail-Seq (n = 3)gydF4y2Ba67年gydF4y2Ba或gydF4y2BabgydF4y2BaPAIso-seq (n = 2)gydF4y2Ba68年gydF4y2Ba。斯皮尔曼等级相关系数之间RNA-Seq测量和聚(A)尾长度是左上角所示角落强调缺乏强有力的关系的两个变量Tail-Seq PAIso-seq。gydF4y2BacgydF4y2Ba,记录最短保利(A)反面(< 35元在TAIL-Seq对应于最低1%,最低3.7% PAIso-seq)相比,所有其他记录对RNA表达Smart-Seq3衡量。中值的分布与水平线显示。盒子里描绘了四分位范围,胡须扩展从铰链最多四分位范围的1.5倍。gydF4y2BadgydF4y2Ba,我们RNA-seq测量使用Smart-seq3从受精卵(n = 4),它使用益生元(dT)启动,比较测量使用SUPeR-Seq (n = 5)gydF4y2Ba69年gydF4y2Ba,它提供了聚(A)独立的量化。这两种方法之间的斯皮尔曼等级相关(p值< 2.2×10所示gydF4y2Ba−16gydF4y2Ba)。gydF4y2BaegydF4y2Ba,日志gydF4y2Ba2gydF4y2BaSUPeR-Seq比Smart-seq3表达式值(轴)计算每个基因和按各自分组聚(A)尾长度(轴),之前报道gydF4y2Ba41gydF4y2Ba。而没有一个系统性偏差测量的函数表达保利(a)尾长度,记录与最短的尾巴(< 17元)略有低估Smart-seq3(克鲁斯卡尔-沃利斯排名和测试;假定值0.016)。gydF4y2Ba
补充信息gydF4y2Ba
补充图1gydF4y2Ba
这个文件包含完整的凝胶图像数据在图1图2和扩展数据。gydF4y2Ba
补充表1gydF4y2Ba
测序的基本定位和过滤数据库。gydF4y2Ba
补充表2gydF4y2Ba
此表包含SNP职位列表,基因的等位变异和相应的氨基酸突出显示在图4。gydF4y2Ba
补充表3gydF4y2Ba
这个表提供了log-fold变化和调整假定值(Benjamini &业务方法)对应的微分分析TE和RNA表达之间的发展阶段。gydF4y2Ba
补充表4gydF4y2Ba
一套背景检测基因提供了FuncAssociate组成gydF4y2Ba75年gydF4y2Ba确定浓缩的基因本体在TE基因显著变化。调整假定值计算在FuncAssociate使用基于排列的方法实现gydF4y2Ba75年gydF4y2Ba。gydF4y2Ba
补充表5gydF4y2Ba
的丰富和耗尽七聚物在基因与微分翻译效率由石棉水泥板gydF4y2Ba55gydF4y2Ba使用默认参数k-mer TSMA方法。使用Benjamini-Hochberg调整假定值计算方法。七聚物被注解为装饰中存在的数据库gydF4y2Ba56gydF4y2Ba如果七聚物在汉明距离1的图案点缀的共识。gydF4y2Ba
补充表6gydF4y2Ba
此表包含缓冲区用于Ribo-ITP的构成方法。gydF4y2Ba
补充表7gydF4y2Ba
此表包含RNA和DNA荧光标记的序列用于Ribo-ITP方法。gydF4y2Ba
补充视频1gydF4y2Ba
代表Ribo-ITP过程的视频gydF4y2BaRibo-ITP过程使用裂解缓冲和1µl每个19元,36元fl的DNA标记,ddCµM [5]。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Ozadam, H。吨位,T。,Han, C.M.et al。gydF4y2Ba单细胞量化核糖体的入住率在小鼠早期发育。gydF4y2Ba自然gydF4y2Ba(2023)。https://doi.org/10.1038/s41586 - 023 - 06228 - 9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586 - 023 - 06228 - 9gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba