摘要
低健康相关生活质量(HRQOL)与糖尿病肾病(DKD)患者不良结局相关。我们检查了与这些患者低HRQOL相关的可改变因素。我们招募了141名DKD患者。采用SF-36 (Short Form 36)问卷评估HRQOL。低HRQOL被定义为比平均值低一个标准差的分数>。抑郁和焦虑采用医院焦虑和抑郁量表(HADS-D和HDAS-A)进行评估。患者的中位年龄为65岁,其中73%为男性。焦虑及抑郁的患病率为8% (n= 11)及17% (n= 24)。40例(28%)患者睡眠质量较差,40例(28%)身体活动水平较低。焦虑、抑郁和睡眠质量差与SF-36评分呈负相关。较高水平的体育活动和估计的肾小球滤过率(eGFR)与较高的SF-36评分相关,后者表明更好的健康状况。较高的抑郁评分(HADS-D评分)与较低的HRQOL相关,不受年龄、性别、吸烟状况、合并症、eGFR、贫血、睡眠质量、焦虑水平和体力活动水平等因素的影响(优势比,1.43;95%置信区间,1.17-1.75)。在临床和心理生理因素中,抑郁是DKD患者低HRQOL的主要决定因素。
简介
糖尿病肾病(DKD)发生在大约40%的糖尿病患者中。尽管最近的治疗取得了进展,DKD的年发病率在过去十年中增加了一倍多1.随着人口老龄化,肥胖越来越普遍,越来越多的人患有心血管疾病,患病率的大幅增加是渐进的2.DKD与全因死亡和心血管疾病的风险增加有关,并且作为全球终末期肾病(ESKD)的主要原因,通过医疗保健费用造成了巨大的负担3..
与健康有关的生活质量(HRQOL)是指个人对生活的信念、看法、经历和期望,这些都可能受到个人健康状况的影响4.糖尿病和肾病患者的HRQOL低于一般人群。此外,现在普遍认为低HRQOL与慢性肾病(CKD)患者心血管疾病和死亡风险增加有关。5,6.更好地了解HRQOL将使临床医生能够提供以患者为中心的护理,并改善长期结果。然而,尽管低HRQOL越来越被认为是不良结果的重要预测因素,但以往的研究主要集中在与HRQOL相关的不可改变的临床因素,如年龄、性别和共病。因此,确定CKD患者低HRQOL相关的潜在可改变的危险因素非常重要。
本研究采用SF-36健康调查问卷对DKD患者进行了与HRQOL相关的临床因素调查。我们特别关注可改变的因素,如抑郁、焦虑、睡眠质量、贫血、血糖控制和身体活动。
方法
研究设计和研究对象
我们在2017年4月至2018年3月期间从一家三级医院的肾内科诊所招募了DKD门诊患者。纳入标准为年龄≥18岁的透析前或透析患者,使用口服降糖药或胰岛素等降糖药。DKD定义为活检证实的糖尿病肾病或临床诊断为肾小球滤过率(eGFR)低于60 mL/min/1.73 m的糖尿病患者2,伴有或不伴有持续蛋白尿3个月或以上,且无任何其他特殊原因7.持续性蛋白尿定义为尿白蛋白-肌酐比值(uACR)≥30 mg/g或尿蛋白-肌酐比值(uPCR)≥0.2 g/g。eGFR是使用慢性肾脏疾病流行病学合作组织的肌酐方程得到的8.所有临床研究均按照2013年赫尔辛基宣言的指导方针进行。所有患者都签署了知情同意书。该研究方案得到了三星首尔医院机构审查委员会的批准。
数据收集与措施
在基线入组时,通过访谈和病历回顾收集年龄、性别、体重指数(BMI)、吸烟状况、合并症、用药史、糖尿病病程和透析等人口统计学数据。采用改良Charlson共病指数(CCI)测量共病负担,包括以下共病条件:心肌梗死、充血性心力衰竭、周围血管疾病、脑血管意外、痴呆、慢性阻塞性肺疾病、结缔组织疾病、消化性溃疡疾病、肝病、糖尿病、肾功能不全、白血病、淋巴瘤、实体瘤、肝病和艾滋病/HIV9.年龄因素从指标中排除,以检查年龄对HRQOL的影响,独立于合并症。由训练有素的人员进行人体测量和血压测量,并在基线时测量实验室数据,包括白细胞计数、血红蛋白(Hb)水平、血清肌酐水平、糖化血红蛋白水平以及uACR或uPCR值。对于透析患者,在HD(血液透析)会议前的周中进行上述测量。
在研究人员的帮助下进行健康相关问卷调查。对于入选的透析患者,问卷是在HD会议的周中回答的。睡眠质量是用与原版相当的匹兹堡睡眠质量指数(PSQI-K)进行测量的。这是一个有效和可靠的筛选工具,以确定“好”和“差”的睡眠10.PSQI由18个问题组成,包括睡眠质量、睡眠潜伏期、睡眠效率、睡眠时间、睡眠障碍、睡眠药物使用和白天功能障碍。每个项目的得分从0到3,得出一个从0到21的整体PSQI得分,得分越高,睡眠质量越低。总分> 5表示睡眠质量差,总分≤5表示睡眠质量好。为了确定焦虑和抑郁水平,使用了医院焦虑和抑郁量表(HADS)11,12.该量表分为焦虑子量表(HADS-A)和抑郁子量表(HADS-D),两者都包含七个混合项目。每个项目有4个回答类别,从0到3,总分从0到21。对于焦虑和抑郁,0-7分被认为是正常,8-10分被认为是边缘异常,11-21分被认为是异常12.韩国版《国际体育活动问卷(IPAQ)简表》记录了最近7天的体育活动情况13.7项IPAQ用于确定在过去7天中进行中等强度和高强度体育活动、步行和不活动的总分钟数。根据IPAQ评分方案,将应答转换为每周代谢等效任务分钟(MET-min/wk)测量14.身体活动水平分为低、中、高。低体力活动被定义为不活动或某些活动不足以归入第2或第3类。适度体育活动被定义为以下三个标准中的任何一个:3天或以上的剧烈运动,每天至少20分钟;5天或以上中等强度的活动或每天至少步行30分钟;或5天或更多的步行、中等强度或高强度活动的组合,达到至少600 MET-min/wk。高强度体育活动定义为以下任何一个标准:高强度活动至少3天,累积至少1500 MET-min/wk或7天或更长时间的步行、中等或高强度活动的任何组合,累积至少3000 MET-min/wk。
HRQOL评估
采用SF-36(2.0版)评价综合HRQOL15,16.它包括36个问题、8个量表(身体功能[PF]、身体问题引起的角色限制[RF]、身体疼痛[BP]、一般健康[GH]、活力[VT]、社会功能[SF]、情绪问题引起的角色限制[RE]和精神健康[MH]),以及两项总括测量。对每个问题的回答都转化为SF-36的等效分数,分数范围从0到100,数值分数越高表明HRQOL越好。PF、RF、BP和GH分量表汇总在物理成分摘要(PCS)中,VT、SF、RE和MH分量表汇总在心理成分摘要(MCS)中。我们将低HRQOL定义为SF-36评分>低于平均值一个标准差(SD),参考了以前对CKD患者的研究17,18.同样,我们将身体健康状况较差和心理健康状况较差分别定义为PCS分数和MCS分数分别低于平均值>个SD。
统计分析
对于分类变量,数据以百分位数表示,对于连续变量,数据以中位数和四分位范围(IQRs)表示。对分类变量采用卡方分析或Fisher精确检验,对连续变量采用Kruskal-Wallis检验,以确定CKD分期的基线特征差异。使用Mann-Whitney秩和检验评估睡眠良好者和睡眠不良者之间SF-36、PCS和MCS评分的差异。使用Jonckheere-Terpstra检验来确定连续变量的趋势显著性。采用Spearman相关系数检验临床参数与SF-36评分之间的关系。采用经年龄、性别、CCI评分、吸烟状况、Hb水平、eGFR和PSQI-K、HADS-A、HADS-D和IPAQ评分调整后的多变量logistic回归分析,研究SF-36评分评估的低HRQOL与临床因素之间的相关性,并以比值比(ORs)和95%可信区间(95% ci)报告结果。在多元logistic回归分析中,我们根据以往研究中证实的潜在混杂因素、单因素分析中与低HRQOL显著相关的变量以及我们感兴趣的变量,选择了混杂因素。通过ROC曲线下面积(AUC)来评估各logistic回归模型的拟合优度。19.在解释最终输出之前,使用参考值为10的方差膨胀因子(VIF)评估变量的多重共线性。同样,通过PCS评分和MCS评分来评估临床因素与低HRQOL的关系,使用上述方法进行了调查。由于透析治疗本身可能是HRQOL与临床因素之间关系的中介因素,因此排除透析患者进行了额外的logistic回归分析。由于缺乏低HRQOL的确切定义,使用线性回归模型对临床因素与SF-36评分作为连续变量的关联进行了上述调整的附加敏感性分析。库克的距离20.用于回归分析,在一组预测变量中寻找有影响的异常值。没有丢失的数据或显著的异常值。所有统计分析均使用SPSS 25.0版本for Windows (IBM, Armonk, NY, USA)、SAS 9.4版本(SAS Institute, Cary, NC)和r4.0.3版本(奥地利维也纳;http://www.R-project.org/).一个p值< 0.05被认为是显著的。
结果
研究参与者的特点
共纳入141例DKD患者,并完成SF-36等问卷调查(补充图。1).中位年龄为65岁(57-72岁),103例(73%)患者为男性。56例患者被归类为CKD 3期,41例被归类为4期,44例被归类为5期,包括28例血液透析患者。整体而言,焦虑及抑郁的患病率为8% (n= 11)及17% (n= 24),基于HADS评分≥8。在24名抑郁症患者中,有7名(29%)正在进行透析。40例(28%)患者睡眠质量较差,40例(28%)身体活动水平较低。
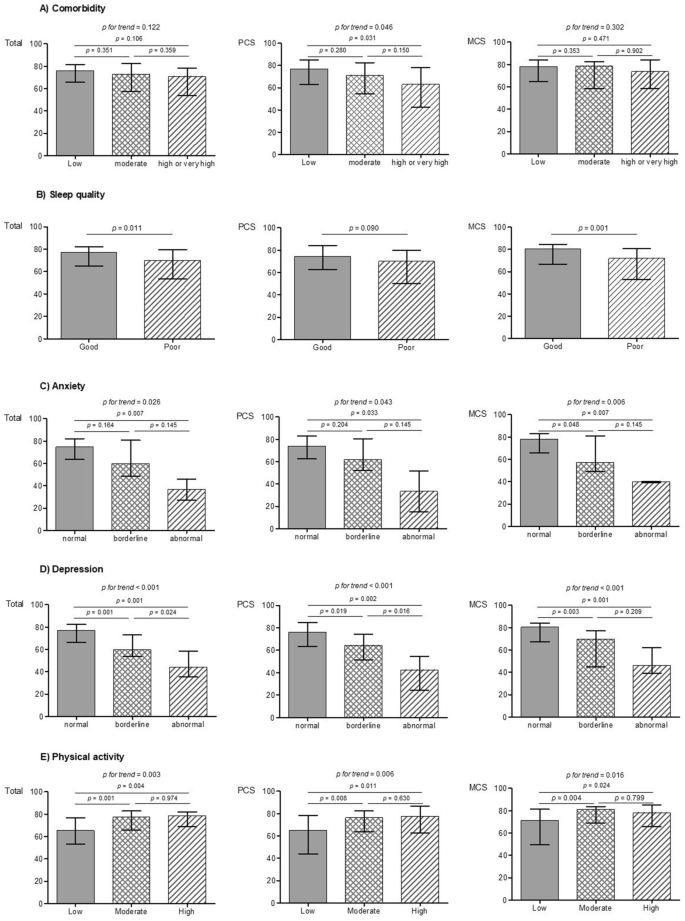
表中总结了CKD分期患者的基线特征1.晚期CKD患者的CCI评分较高(p趋势< 0.001)。同样,晚期CKD患者的PSQI-K评分较高(3期,2.0 [1.0-5.0];阶段4,2.0 [1.0-5.5];阶段5,4.0 [2.3-8.0],p= 0.005趋势)。百分之二十三(n= 13)的CKD 3期患者中,24% (n= 10), 39% (n= 17)的5期患者睡眠质量较差(p= 0.1趋势)。焦虑评分、抑郁评分和身体活动水平在CKD阶段没有差异。SF-36评分随着CKD晚期阶段(3期,78.8 [71.0-82.1];Stage 4, 70.5 [56.4-81.5];阶段5,69.8 [56.9-81.6],p= 0.012趋势)。
SF-36得分分布
SF-36评分根据CCI评分、睡眠质量、焦虑、抑郁和身体活动水平的分布如图所示。1.SF-36评分与CCI评分无差异(p= 0.122;无花果。1a).相反,睡眠质量差的人比睡眠质量好的人HRQOL得分更低;SF-36总分中位数(IQR)为69.9 (53.3-79.6),77.0 (64.8-82.2;p= 0.011)。1b). HADS-A评分越高的患者SF-36总分越低;HADS-A评分正常、边缘性异常和异常患者的SF-36总分分别为74.8(63.6-82.0)、59.8(48.7-80.1)和36.7 (27.2-46.1)(p趋势= 0.026)(图1c).同样,HADS-D评分越高的患者SF-36总分越低;HADS-D评分正常、边缘性异常和异常患者的SF-36总分分别为77.0(66.1-82.3)、59.8(53.5-73.1)和44.1 (35.2-58.4)(p趋势< 0.001)(图;1d).运动水平越高的受试者SF-36总分越高;低、中、高运动水平患者的SF-36总分分别为65.4(53.3-76.9)、77.6(65.8-82.8)和78.6 (68.9-82.1)(p= 0.003为趋势)(图;1e)。
临床因素与HRQOL的关系
分析临床变量与HRQOL评分之间的相关性。如表所示2SF-36总分与焦虑、抑郁、睡眠质量呈负相关。HRQOL评分与eGFR和体力活动水平呈正相关。
在多变量logistic回归分析中,对年龄、性别、吸烟状况、CCI评分、Hb水平、eGFR和PSQI-K、HADS-A、HADS-D和IPAQ评分进行了调整,以确定由SF-36总分评估的与低HRQOL相关的因素,抑郁评分(HADS-D)与低HRQOL相关,与年龄、性别、吸烟状况、合并症(CCI评分)、eGFR、贫血、睡眠质量(PSQI-K评分)、焦虑(HADS-A评分)、体育活动水平(IPAQ评分);每1分增量的OR (95% CI)为1.43 (1.17-1.75)(p< 0.001)(表3.).然而,在多变量logistic回归分析中,eGFR、PSQI-K评分、焦虑评分和IPAQ评分与低HRQOL的相关性被削弱。特别是HADS-D评分与身体健康明显相关;HADS-D评分每增加1分的OR (95% CI)为1.36 (1.13-1.64)(p= 0.001)。然而,HADS-D评分与心理健康之间的联系减弱了。相反,焦虑评分(HADS-A)与低心理健康独立相关(表2)3.).拟合模型显示模型与观测数据无显著差异(AUC值,总体HRQOL为0.8515;0.7949 .身体健康;0.8511金属生命值)。VIF没有证据表明自变量之间存在多重共线性问题(所有VIF < 3)。
敏感性分析
我们进行了敏感性分析,以确认结果的稳健性。在线性回归分析中,HADS-D评分是与HRQOL相关的最有效的可改变因素;较高的HADS-D评分与较低的SF-36总分、PCS评分和MCS评分相关(补充表1).
在排除透析患者的分析中(n= 28),观察到抑郁症与低HRQOL之间存在一致的相关性;SF-36总分和PCS评分对低HRQOL的ORs (95% ci)分别为1.43(1.14-1.80)和1.31 (1.07-1.60)p< 0.05,补充表2).此外,还观察到焦虑和心理健康状况不佳之间存在一致的关联;HADS-A评分每增加1分的OR (95% CI)为1.32 (1.03-1.69)(p= 0.031)。
讨论
我们检查了DKD 3-5期患者的临床和心理生理因素,包括与HRQOL相关的健康相关行为,尤其关注可改变的因素。我们发现抑郁症是这些患者低HRQOL的主要决定因素,独立于包括年龄、性别、合并症、吸烟状况、肾功能、贫血、血糖控制水平、睡眠质量、焦虑和体力活动水平等因素。抑郁症和低HRQOL之间的这种联系,在身体健康领域尤其明显。
大约20-40%的透析前CKD患者以及维持性透析患者有抑郁症21.糖尿病尤其被认为是CKD患者抑郁的危险因素22.此外,DKD进展与抑郁症风险增加有关23.在CKD或ESKD患者中,抑郁症与医疗保健使用率增加、治疗依从性降低以及社会和职业角色功能差相关24,25,26.此外,尽管HRQOL是一个重要的以患者为中心的结局,而且低HRQOL越来越被认为是不良结局的重要预测因子,如CKD患者进展到ESKD以及全因和心血管死亡,但以往的研究主要集中在与HRQOL相关的不可改变的临床因素,如年龄、性别和共病。抑郁症作为一个可改变的因素已被证明对糖尿病患者的HRQOL有负面影响27和慢性肾病28,29.一些作者甚至报告说,抑郁症状与低HRQOL的相关性比透析充分性、其他人口统计学变量和低血红蛋白水平的相关性更大30.,31.然而,以往的研究表明,抑郁症和低HRQOL之间的关系可能受到与健康相关行为的影响,如睡眠质量、体育活动和吸烟状况。已知CKD患者低体力活动水平和睡眠质量差与低HRQOL有关32,33.在这项研究中,低体力活动水平和睡眠质量差也与低HRQOL有关。然而,在对不可改变因素和可改变因素进行调整后,抑郁症是与低HRQOL相关的最相关的可改变因素。特别是,我们发现抑郁症与身体健康状况不佳的关系比与心理健康状况不佳的关系更明显。和我们之前的研究结果相似34多变量分析显示,透析前CKD患者PCS评分比MCS评分受损更严重,且PCS评分与抑郁呈负相关。当抑郁被添加到糖尿病状态时,抑郁对HRQOL的影响对PCS评分比MCS评分更具可加性35.除了抑郁症,CKD患者的低HRQOL还与一些社会人口学和临床因素有关。慢性肾功能不全队列(CRIC)和西班牙裔CRIC研究报道,年龄较小、女性、糖尿病、外周血管疾病、充血性心力衰竭、低教育水平、肥胖和低eGFR在大量不同的CKD队列中与低HRQOL显著相关5.贫血也可能对HRQOL产生负面影响,在CKD患者中,血红蛋白校正与改善HRQOL相关36.然而,在本研究中,在多变量分析中,只有抑郁与低HRQOL相关。
本研究有一定的局限性,在解释结果时应加以考虑。首先,我们的研究结果在评估抑郁症和HRQOL之间的因果关系方面是有限的,因为这项研究是横断面的。因此,低HRQOL与抑郁症之间可能存在反向因果关系。然而,以往对CKD患者的研究大多表明抑郁症是低HRQOL的危险因素。此外,低HRQOL作为抑郁症的危险因素,很可能在各种危险因素与抑郁症的关联中起到中介作用。此外,尽管我们在与DKD患者生活质量相关的分析中对混杂因素进行了调整,但仍可能存在未测量的因素。特别是,婚姻状况、教育水平和收入水平等因素可能影响生活质量,但本研究未涉及这些因素。第二,本研究包括透析患者。透析治疗本身可降低HRQOL,增加焦虑、抑郁和睡眠障碍等症状,并可能作为这些因素与HRQOL之间关联的混杂因素。然而,当我们排除透析患者进行敏感性分析时,结果没有变化。 Third, we used the HADS instead of structured clinical interviews to assess depression and anxiety; hence, misclassification was possible. Nevertheless, the HADS is known to be a reliable and valid tool for identifying depression in patients with CKD and ESKD. Moreover, this misclassification error was nondifferential, which would likely bias our results toward the null. Last, this was a single-center study with a relatively small sample size. Moreover, DKD patients with an eGFR ≥ 60 mL/min/1.73 m2被排除在本研究之外,因此限制了我们结果的广泛性,特别是对于保留肾功能的DKD人群。因此,我们的研究强调了可能需要进行随机对照试验,以评估DKD患者抑郁与低HRQOL之间的时间关系,并进一步评估早期发现抑郁和适当的抑郁护理对这些患者健康结果的影响。尽管存在这些局限性,但我们研究的优势在于,我们进行了全面的分析,包括健康相关行为,如吸烟、睡眠质量和体育活动,以及可改变和不可改变的临床特征,以检查与DKD患者HRQOL相关的因素。
结论
本研究调查了与DKD患者低HRQOL相关的各种因素,并确定抑郁症是生活质量降低的主要决定因素。这些发现强调了评估DKD患者抑郁症的重要性,并将这一评估纳入临床医生的管理决策,敦促未来的研究提供生物学基础并评估因果关系。
数据可用性
在当前研究期间生成和/或分析的数据集可根据合理要求从通信作者处获得。
参考文献
Persson, F. & Rossing, P.糖尿病肾病的诊断:技术现状和未来展望。肾脏Int。增刊。2011(8), 2 - 7日。https://doi.org/10.1016/j.kisu.2017.10.003(2018)。
Alicic, R. Z, Rooney, M. T. & Tuttle, K. R.糖尿病肾病:挑战、进展和可能性。中国。j。Soc。Nephrol。12, 2032 - 2045。https://doi.org/10.2215/CJN.11491116(2017)。
Afkarian, M。et al。肾脏疾病和2型糖尿病死亡风险增加j。Soc。Nephrol。24, 302 - 308。https://doi.org/10.1681/asn.2012070718(2013)。
Finkelstein, F. O., Wuerth, D. & Finkelstein, S. H.与健康相关的生活质量和CKD患者:肾脏学界面临的挑战。肾脏Int。76, 946 - 952。https://doi.org/10.1038/ki.2009.307(2009)。
波特,a.c.et al。CKD成人健康相关生活质量的预测因素和结果中国。j。Soc。Nephrol。11, 1154 - 1162。https://doi.org/10.2215/CJN.09990915(2016)。
梅普斯,d.l.。et al。健康相关的生活质量作为死亡率和住院的预测因素:透析结果和实践模式研究(DOPPS)肾脏Int。64, 339 - 349。https://doi.org/10.1046/j.1523-1755.2003.00072.x(2003)。
美国国家肾脏协会(National Kidney, F. KDOQI)糖尿病和CKD临床实践指南:2012年更新。点。J.肾病。60, 850 - 886。https://doi.org/10.1053/j.ajkd.2012.07.005(2012)。
印克,洛杉矶。et al。从血清肌酐和胱氨酸抑素C估计肾小球滤过率。心血管病。j .地中海。367、页。https://doi.org/10.1056/NEJMoa1114248(2012)。
Beddhu, S., Bruns, F. J., Saul, M., Seddon, P. & Zeidel, M. L.一个简单的共病量表预测透析患者的临床结果和成本。点。j .地中海。108, 609-613(2000)。
孙,S. I.,金,D. H.,李,M. Y. &赵,Y. W.匹兹堡睡眠质量指数的可信度和有效性。睡眠呼吸16, 803 - 812。https://doi.org/10.1007/s11325-011-0579-9(2012)。
Bjelland, I., Dahl, A. A., Haug, T. T. & Neckelmann, D.医院焦虑和抑郁量表的有效性。最新文献综述。j . Psychosom。Res。52, 69-77(2002)。
兹格蒙德,A. S. &斯奈斯,R. P.医院焦虑抑郁量表。Acta Psychiatr。Scand。67, 361-370(1983)。
克雷格,c.l.。et al。国际体育活动问卷:12国信度和效度。医学科学。体育Exerc。35, 1381 - 1395。https://doi.org/10.1249/01.mss.0000078924.61453.fb(2003)。
国际体育活动问卷(IPAQ)。国际体育活动问卷(IPAQ)数据处理和分析指南:短表格和长表格。2005年(2020年7月1日访问)。https://sites.google.com/site/theipaq/.
韩,C. W.,李,E. J., Iwaya, T., Kataoka, H.和Kohzuki, M.韩国版36项健康调查简表的开发:韩国健康老年人和老年患者的健康相关生活质量。东北J.实验医学。203, 189-194(2004)。
韦尔,J. E. Jr.和舍伯恩,C. D. MOS 36项简短健康调查(SF-36)。一、概念框架和项目选择。医疗保健。30., 473-483(1992)。
哦,t。R。et al。健康相关生活质量与慢性肾脏进展的关系科学。代表。9, 1-9(2019)。
莫迪,G. K。et al。印度CKD的非医疗因素与健康相关生活质量中国。j。Soc。Nephrol。15, 191-199(2020)。
Steyerberg, E. W. & Vergouwe, Y.迈向更好的临床预测模型:开发的七个步骤和验证的ABCD。欧元。心J。35, 1925 - 1931。https://doi.org/10.1093/eurheartj/ehu207(2014)。
线性回归中有影响观测的检测。技术计量学1915日。https://doi.org/10.1080/00401706.1977.10489493(1977)。
帕尔默。et al。慢性肾脏疾病中抑郁症的患病率:观察性研究的系统回顾和荟萃分析肾脏Int。84, 179 - 191。https://doi.org/10.1038/ki.2013.77(2013)。
Shirazian, S。et al。慢性肾病和终末期肾病中的抑郁:诊断、流行病学和管理的异同肾脏Int。代表。2, 94 - 107。https://doi.org/10.1016/j.ekir.2016.09.005(2017)。
Takasaki, K., Babazono, T., Ishizawa, K., Miura, J. & Uchigata, Y.糖尿病肾病和抑郁症之间的关系:使用东京女子医科大学糖尿病研究中心(DIACET)的横断面分析。BMJ开放糖尿病护理4, e000310。https://doi.org/10.1136/bmjdrc-2016-000310(2016)。
Abbas Tavallaii, S, Ebrahimnia, M, Shamspour, N. & Assari, S.抑郁对血液透析治疗终末期肾病患者医疗保健利用的影响。欧元。j .实习生。地中海。20., 411 - 414。https://doi.org/10.1016/j.ejim.2009.03.007(2009)。
Sensky, T., Leger, C. & Gilmour, S.与慢性血液透析患者坚持饮食和液体限制方案相关的社会心理和认知因素。Psychother。Psychosom。65, 36-42。https://doi.org/10.1159/000289029(1996)。
威尔斯,k.b.。et al。抑郁症患者的功能和幸福。医学结果研究的结果《美国医学会杂志》262, 914-919(1989)。
Mishra, s.r., Sharma, A, Bhandari, p.m., Bhochhibhoya, S. & Thapa, K. 2型糖尿病患者的抑郁和健康相关生活质量:尼泊尔的一项横断面研究。《公共科学图书馆•综合》10, e141385。https://doi.org/10.1371/journal.pone.0141385(2015)。
Lee Y. J., Kim, M. S., Cho, S. & Kim, S. R.抑郁和焦虑与透析前慢性肾病患者生活质量降低的关系。Int。j .中国。Pract。67, 363 - 368。https://doi.org/10.1111/ijcp.12020(2013)。
王文良。et al。老年慢性肾病患者抑郁症的患病率以及抑郁症与肾功能和健康相关生活质量之间的关系:一项多中心横断面研究中国。间歇雨刷。老化14, 905 - 913。https://doi.org/10.2147/cia.s203186(2019)。
斯蒂尔,t.e.。et al。腹膜透析患者的生活质量。j . Nerv。表示“状态”。说。184, 368 - 374。https://doi.org/10.1097/00005053-199606000-00007(1996)。
巴斯克斯,我。et al。低共病年轻血液透析患者的社会心理因素与生活质量。J Nephrol16, 886-894(2003)。
蔡永昌et al。体力活动与慢性肾脏疾病心血管和肾脏结局及生活质量的关系《公共科学图书馆•综合》12, e0183642。https://doi.org/10.1371/journal.pone.0183642(2017)。
宋,s.a。et al。透析前CKD患者的睡眠时间与健康相关生活质量中国。j。Soc。Nephrol。13, 858 - 865。https://doi.org/10.2215/CJN.11351017(2018)。
阿哈吉,M。et al。透析前慢性肾病患者生活质量的决定因素:SF-36变异沙特医科大学。39, 653-661(2018)。
戈德尼,R. D.,菲利普斯,P. J.,费舍尔,L. J. &威尔逊,D. H.糖尿病、抑郁症和生活质量:一项人口研究。糖尿病护理27, 1066 - 1070。https://doi.org/10.2337/diacare.27.5.1066(2004)。
Leaf, D. E. & Goldfarb . D. S.对接受贫血治疗的CKD患者健康相关生活质量数据的解释和回顾。肾脏Int。75, 15 - 24。https://doi.org/10.1038/ki.2008.414(2009)。
确认
作者感谢三星生物医学研究所(Samsung Biomedical research Institute)的研究协调员恩吉·林(Eun-ji Lim)为这项研究招募所有受试者并收集数据。
资金
本研究由Genome & Company Co. Ltd(批准号:;PHO0171531)。
作者信息
作者及隶属关系
贡献
J.E.L.参与了研究设计、数据收集、分析、结果解释以及手稿的撰写和审查。Y.-J.L.对数据的解释,对手稿的审查和对文章重要知识内容的修改做出了贡献。S.K.参与了数据的收集、分析、结果的解释和手稿的撰写。h.r.j.、E.Y.J.和J.J.对数据的概念和解释做出了贡献。w.h., y.g.k.和D.J.K.参与了数据的解释,审阅了手稿并提出了意见。所有作者都同意了手稿的最终版本。J.E.L.是这项工作的担保人,因此,它可以完全访问研究中的所有数据,并对数据的完整性和数据分析的准确性负责。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
金善,全俊,李永杰。et al。抑郁是糖尿病肾病患者健康相关生活质量的主要决定因素。Sci代表12, 12159(2022)。https://doi.org/10.1038/s41598-022-15906-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-15906-z